Deutscher Rheumatologiekongress 2025
Deutscher Rheumatologiekongress 2025
Die Verwendung von Januskinase-Inhibitoren vor und nach den Sicherheitsempfehlungen der European Medicines Agency (EMA) – Analyse des deutschen RHADAR Registers
Text
Einleitung: Sicherheitsempfehlungen für Januskinase-Inhibitoren (JAKi), die 2023 von der Europäischen Arzneimittel-Agentur (EMA) herausgegeben wurden, beeinflussten das Verordnungsmuster dieser Medikamente zur Behandlung der rheumatoiden Arthritis (RA) [1]. Über die längerfristigen Auswirkungen solcher Empfehlungen in der klinischen Routine ist jedoch bisher wenig bekannt.
Methoden: Es erfolgte eine erneute retrospektive Analyse der deutschen RHADAR-Datenbank [2] hinsichtlich erwachsener RA-Patient:innen und der Dokumentation einer neu begonnenen Therapie mit einem Januskinase-Inhibitor (JAKi), einem Tumornekrosefaktor-Inhibitor (TNFi) oder einem Interleukin-6-Rezeptor-Inhibitor (IL-6Ri). Die Daten wurden in halbjährliche Intervalle von Quartal (Q)2/2020 bis Q3/2024 unterteilt. Der Zeitraum von Q4/2022 bis Q1/2023 folgte unmittelbar auf die erste Sicherheitsempfehlung des Pharmacovigilance Risk Assessment Committee (PRAC) der EMA [3]. Der Zeitraum Q2/2023 bis Q3/2023 folgte direkt auf die Kommunikation der neuen JAKi-Sicherheitsempfehlungen an medizinische Fachkreise (Rote-Hand-Brief) [4].
Ergebnisse: Zwischen dem 1. April 2020 und dem 30. September 2024 wurden von den behandelnden Ärzt:innen insgesamt 3.492 neu begonnene Therapien mit TNFi (1.770 [50,7%]), JAKi (1.269 [36,3%]) und IL-6Ri (453 [13,0%]) dokumentiert (Tabelle 1 [Tab. 1]). JAKi wurden in den ersten beiden Halbjahreszeiträumen zunehmend eingesetzt (von 29,5% dieser Therapien in Q2/2020–Q3/2020 auf 46,9% in Q2/2021–Q3/2021; Odds Ratio [OR] 2,11; p<0,001) (Abbildung 1 [Fig. 1]). Der Anteil neu initiierter JAKi-Therapien sank nach den PRAC-Empfehlungen signifikant (30,8%; OR im Vergleich zum Höchstwert 0,51; p<0,001) und nochmals nach dem Rote-Hand-Brief (24,4% /Tiefstwert; OR im Vergleich zum Höchstwert 0,37; p<0,001). Ab dem Q4/2023-Q1/2024 begannen die Verordnungszahlen wieder anzusteigen (32,8%, OR 1,52 im Vergleich zum Vorhalbjahr/Tiefstwert; p=0,0391) erreichten aber noch nicht wieder das Spitzenhalbjahr (OR 0,55; p<0,001). Dabei zeigte sich eine zunehmende Verlagerung von JAKi aus früheren Therapielinien in die hinteren Therapielinien (>3rd Line) (Abbildung 2 [Fig. 2]).
Tabelle 1: Patient:innencharakteristika bei Therapiestart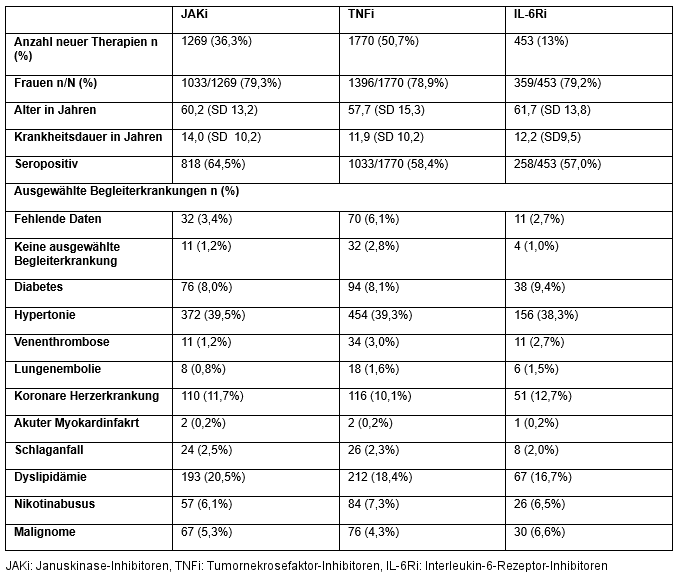
Abbildung 1: Veränderungen des Anteils von JAKi Neuverordnungen vor und nach den Sicherheitsempfehlungen der EMA. 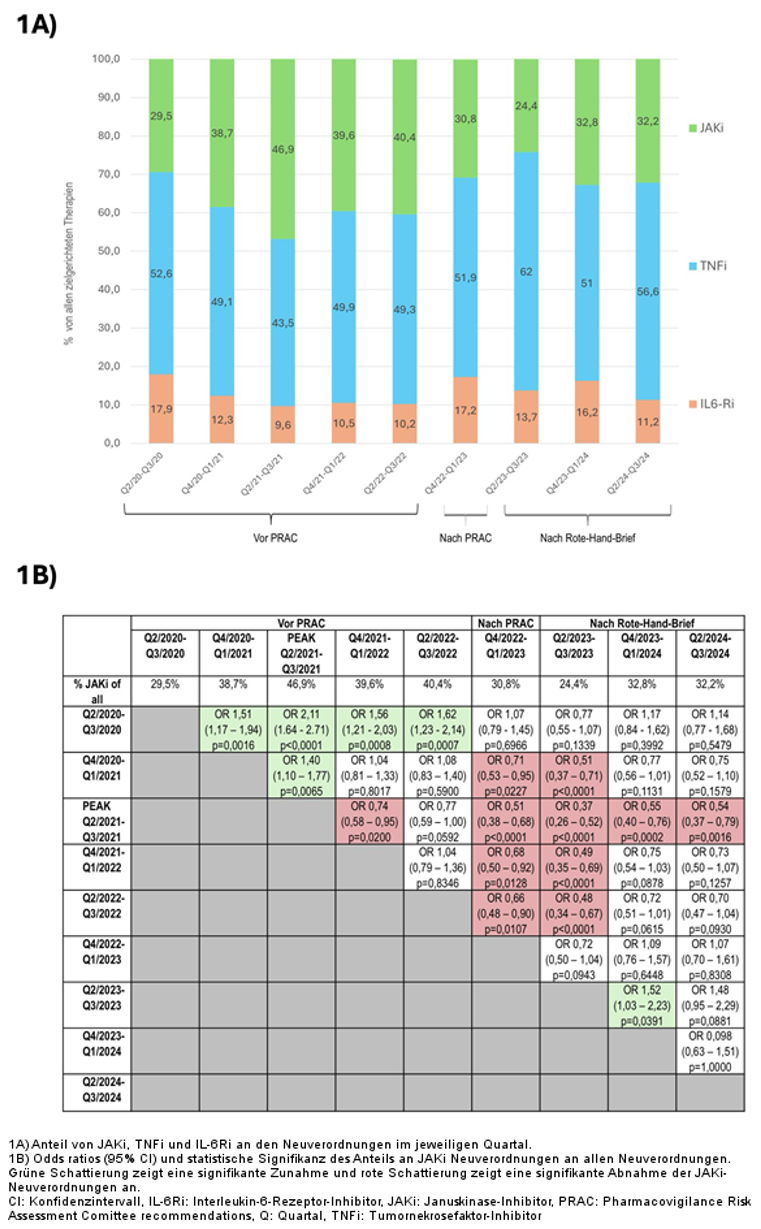
Abbildung 2: Veränderungen der Therapielinie, in der JAKi erstmalig verordnet wurden in Abhängigkeit von den EMA Empfehlungen.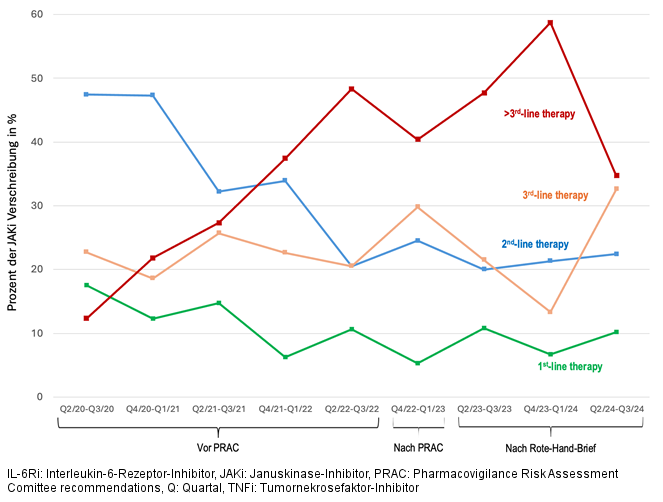
Schlussfolgerung: Diese explorative Studie deutet darauf hin, dass die Sicherheitsempfehlungen der EMA weiterhin Einfluss auf die Therapie mit JAKi nehmen. Ab dem Quartal 04/2023 kam es wieder zu einem Anstieg der Verordnungszahlen, die aber noch nicht das Ausgangsniveau vor den Sicherheitsempfehlungen erreicht haben.
References
[1] Strunz PP, Risser LM, Englbrecht M, Witte T, Froehlich M, Schmalzing M, Gernert M, Hueper S, Bartz-Bazzanella P, von der Decken C, Karberg K, Gauler G, Späthling-Mestekemper S, Kuhn C, Vorbrüggen W, Welcker M, Kleinert S. Use of Janus kinase inhibitors before and after European Medicines Agency safety recommendations: a retrospective study. Front Immunol. 2024 Aug 22;15:1445680. DOI: 10.3389/fimmu.2024.1445680[2] Kleinert S, Bartz-Bazzanella P, von der Decken C, Knitza J, Witte T, Fekete SP, Konitzny M, Zink A, Gauler G, Wurth P, Aries P, Karberg K, Kuhn C, Schuch F, Späthling-Mestekemper S, Vorbrüggen W, Englbrecht M, Welcker M; RHADAR Group. A Real-World Rheumatology Registry and Research Consortium: The German RheumaDatenRhePort (RHADAR) Registry. J Med Internet Res. 2021 May 20;23(5):e28164. DOI: 10.2196/28164
[3] European Medicines Agency. EMA confirms measures to minimize risk of serious side effects with Janus kinase inhibitors for chronic inflammatory disorders. 11 Nov 2022 [zugegriffen am 8 Apr 2024]. Verfügbar unter: https://www.ema.europa.eu/en/news/ema-confirms-measures-minimise-risk-serious-side-effects-janus-kinase-inhibitors-chronic-inflammatory-disorders#:~:text=EMA's%20human%20medicines%20committee%20(CHMP,treat%20several%20chronic%20inflammatory%20disorders
[4] European Medicines Agency. Cibinqo (abrocitinib), Jyseleca (filgotinib), Olumiant (baricitinib), Rinvoq (Upadacitinib) and Xeljanz (tofacitinb) — Updated recommendations to minimize the risks of malignancy, major adverse cardiovascular events, serious infections, venous thromboembolism and mortality with use of Janus kinase inhibitors (JAKi). 30 March 2023 [zugegriffen am 8 Apr 2024]. Available: https://www.ema.europa.eu/en/documents/dhpc/direct-healthcare-professional-communication-dhpc-updated-recommendations-minimise-risks-malignancy-major-adverse-cardiovascular-events-serious-infections-venous-thromboembolism-and-mortality-use_en.pdf




