Deutscher Rheumatologiekongress 2025
Deutscher Rheumatologiekongress 2025
Real-World-Evidenz-(RWE)-Ergebnisse zur Anwendung des weltweit ersten Tocilizumab Biosimilars bei rheumatoider Arthritis – 6-Monats-Daten der deutschen RUBY-Kohorte
Text
Einleitung: Die Behandlung der rheumatoiden Arthritis (RA) erfordert eine langfristige medikamentöse Basistherapie, um die Krankheitsaktivität zu kontrollieren und die Lebensqualität der Patienten zu verbessern. Seit November 2023 ist das Biosimilar Tocilizumab (FK-Toci, Fresenius Kabi), ein Interleukin-6 (IL-6)-Rezeptorantagonist, zugelassen. Es stellt eine neue Therapieoption dar, aufgrund der kurzfristigen Zulassung liegen noch keine Daten zur Therapiepersistenz im klinischen Alltag vor.
Methoden: RUBY ist eine nicht-interventionelle, prospektive, multizentrische Phase-IV-Studie zur Untersuchung der Persistenz von FK-Toci bei erwachsenen Patienten mit RA (Wechsel vom Originator oder Beginn mit FK-Toci). Die Nachbeobachtungszeit beträgt bis zu 52 Wochen. Erhoben wurden Demographie-, Therapiecharakteristika-, Krankheitsaktivität- und Verträglichkeitsdaten. Hier werden die Ergebnisse der ersten 6-Monate präsentiert (cut-off November 2024).
Ergebnisse: Von März bis November 2024 wurden 219 Patienten in 39 Zentren in Deutschland eingeschlossen, davon 62,1% Tocilizumab-naiv. Die Mehrheit der Patienten erhielt FK-Toci subkutan (78,5%) und in Monotherapie (57,1%). 6 Patienten (2,7%) widerriefen ihre Studieneinwilligung. 11 Patienten (5,0%) brachen die Therapie aufgrund unerwünschter Ereignisse (UE) ab. Die häufigsten UE mit möglichem Therapiezusammenhang waren Kopfschmerzen, Reaktionen an der Einstichstelle (je n=5, 2,3%), absichtliche Unterdosierung und Atemwegsinfektionen (je n=3, 1,4%). Schwere UE mit möglichem Therapiezusammenhang traten bei 2 Patienten auf (0,9%, Erysipel). Therapieabbrüche aufgrund unzureichender Wirksamkeit oder Todesfälle traten nicht auf.
In der 6-Monats-Interimsanalyse konnten 212 Patienten ausgewertet werden, von denen 86,8% (95% CI: 81,6% – 90,7%) nach wie vor mit FK-Toci behandelt wurden, darunter 88,9% der vom Originator umgestellten und 85,5% der neu behandelten Patienten.
Der mittlere Krankheitsaktivitätswert nach Patienten-Einschätzung (PGA-Patient Global Assessment) konnte innerhalb von 6 Monaten von 48,3 mm (±24,2) auf 36,1 (±23,1) und nach Arzteinschätzung (Physician Global Assessment) von 33,9 (±25,9) auf 12,9 (±15,1) gesenkt werden. Der Disease Activity Score-28 (DAS28)-CRP verringerte sich innerhalb der ersten 6 Monate von 3,0 (SD 1,5) auf 2,1 (SD 1,0; Abbildung 1 [Fig. 1]).
Abbildung 1: Bewertung der Krankheitsaktivität unter FK-Toci im Verlauf von 6 Monaten: (a) Patienteneinschätzung (PGA) und (b) Einschätzung des Rheumatologen (PhGA; 100 mm-VAS) sowie Verlauf des Disease Activity Score (c) DAS28-BSG und (d) DAS28-CRP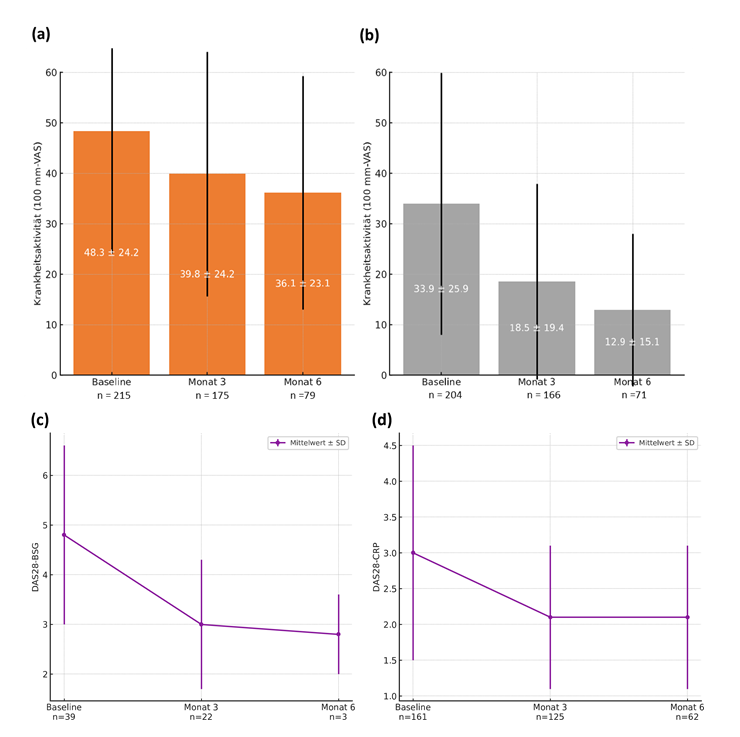
Schlussfolgerung: Die RUBY-Studie bestätigt eine Persistenzrate von über 80% und ein konsistentes Sicherheitsprofil der FK-Toci-Therapie nach sechs Monaten. Die Ergebnisse tragen zur besseren Charakterisierung der Wirksamkeit und Sicherheit von FK-Toci unter Real-World-Bedingungen bei. Prädiktoren für die Therapietreue werden weiter analysiert, um zusätzliche Erkenntnisse zur Langzeitwirksamkeit und -adhärenz zu gewinnen.
Tabelle 1 [Tab. 1]
Tabelle 1: Demographische und klinische Charakteristika der Studienkohorte (n=219).




