Deutscher Rheumatologiekongress 2025
Deutscher Rheumatologiekongress 2025
Autoimmunität aggraviert durch Ashwagandha?
Text
Vorgeschichte: Ein 41-jähriger Patient wurde aufgrund einer unklaren Leberwerterhöhung eingewiesen. Seit längerem bestanden eine verminderte Belastbarkeit sowie steroidsensible Arthralgien/Arthritiden wechselnder Lokalisation. Aufgrund rechtsthorakaler Schmerzen war ambulant ein CT-Thorax mit Nachweis einer rechtsseitigen Pleuritis sowie eines Pleuraergusses rechts erfolgt. Zur Behandlung der muskuloskelettalen Schmerzen hatte der Patient bis dato über 3 Monate Ashwagandha/Schlafbeere (Withania somnifera)-Pulver eingenommen. An Vorerkrankungen bestanden eine Arterielle Hypertonie, Adipositas Grad II sowie Z.n. Löfgren-Syndrom. Bei Nachweis von Myeloperoxidase-spezifischen Anti-Neutrophilen zytoplasmatischen Antikörpern (MPO-ANCA) erfolgte die Verlegung in unsere Klinik.
Leitsymptom bei Krankheitsmanifestation: Unklare Leberwerterhöhung, Arthritis/Arthralgien, rechtsseitige Thoraxschmerzen
Diagnostik:
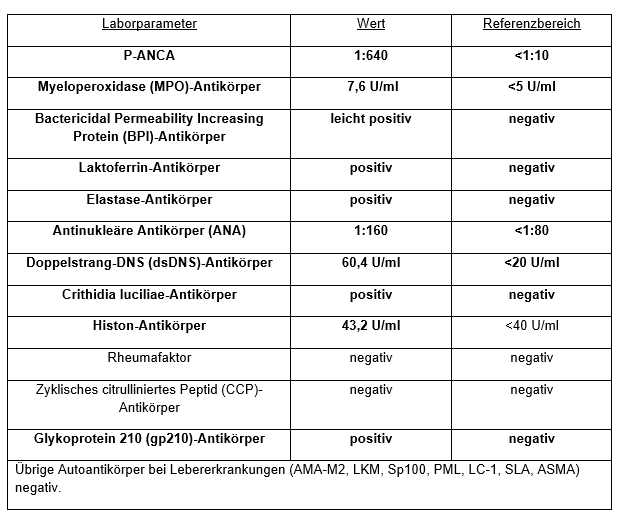
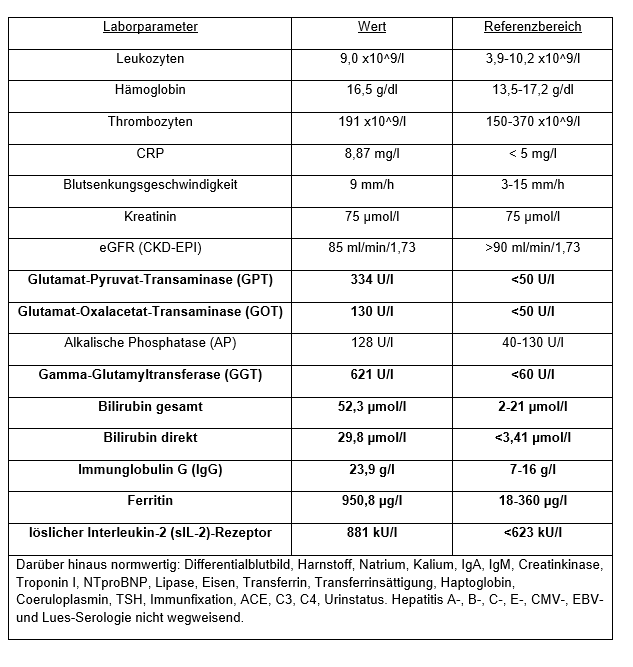
Labor: Autoimmunserologie: Sonographie-Abdomen: Steatosis hepatis Grad I-II, Splenomegalie.
Histopathologie Leberbiopsie: portal betonte Entzündung mit geringer Interface-Aktivität sowie einer mäßiggradigen Fibrose, passend zu medikamentös-toxischem Schaden.
CT-Thorax: Pleuraergusssaum rechts, Pleuritis rechter Unterlappen, Splenomegalie.
Arthrosonographie: Gonarthritis.
Kniegelenkspunktion: 4.380 Leukozyten/µl.
Therapie: Es wurde eine Mikroskopische Polyangiitis diagnostiziert und eine remissionsinduzierende Therapie mit Prednisolon (1 mg/kg Körpergewicht) sowie 940 mg Rituximab (RTX) nach RAVE-Schema [1] initiiert. Die Klassifikationskriterien zur Diagnose eines Systemischen Lupus erythematodes (SLE) waren ebenfalls erfüllt.
Weiterer Verlauf: Die Leberwerterhöhung wurde als medikamentös-toxisch durch die Einnahme von Ashwagandha gewertet. Eine potenziell leberschädigende Wirkung durch Ashwagandha ist bekannt [2], [3]. Die Leberwerte normalisierten sich nach Absetzen von Ashwagandha.
Unter der remissionsinduzierenden Therapie kam es zu einer kompletten Regredienz der Beschwerdesymptomatik. Laborchemisch zeigte sich nach 3 Monaten eine periphere B-Zell-Depletion unter RTX. Der MPO-ANCA war normal, aber Lactoferrin- und Elastase-ANCA sowie dsDNS-Antikörper weiterhin positiv. Es wurde eine remissionserhaltende Therapie mit RTX nach MAINRITSAN-Schema4 (500 mg alle 6 Monate) eingeleitet.
Ein Zusammenhang zwischen der Einnahme von Ashwagandha und einer Induktion von Autoantikörpern wurde in der Literatur bislang nicht beschrieben. Zu diskutieren ist in diesem Fall, ob es sich bei der Erkrankung um eine genuine MPO-ANCA-assoziierte Vaskulitis oder DD um einen SLE handelt und ob die übrigen Autoantikörper auf Grundlage einer bereits vorhandenen Autoimmun-Prädisposition möglicherweise durch Ashwagandha induziert worden sind.
Ashwagandha gilt als potenter Immunstimulator, welcher über eine Modulation sowohl der angeborenen als auch der adaptiven Immunität wirkt, wobei die zugrunde liegenden Mechanismen noch nicht vollständig bekannt sind [3], [4], [5]. Um bei Patienten mit bereits vorliegender Autoimmunerkrankung über eine immunstimulierende Wirkung von Ashwagandha eine Aggravation der Erkrankung zu verhindern, sollte der Einsatz bei diesen Patienten sicherheitshalber vermieden werden [3].
Tabelle 1 [Tab. 1]
Tabelle 2 [Tab. 2]
References
[1] Stone JH, Merkel PA, Spiera R, Seo P, Langford CA, Hoffman GS, Kallenberg CG, St Clair EW, Turkiewicz A, Tchao NK, Webber L, Ding L, Sejismundo LP, Mieras K, Weitzenkamp D, Ikle D, Seyfert-Margolis V, Mueller M, Brunetta P, Allen NB, Fervenza FC, Geetha D, Keogh KA, Kissin EY, Monach PA, Peikert T, Stegeman C, Ytterberg SR, Specks U; RAVE-ITN Research Group. Rituximab versus cyclophosphamide for ANCA-associated vasculitis. N Engl J Med. 2010 Jul 15;363(3):221-32. DOI: 10.1056/NEJMoa0909905[2] Philips CA, Valsan A, Theruvath AH, Ravindran R, Oommen TT, Rajesh S, Bishnu S, Augustine P; Liver Research Club India. Ashwagandha-induced liver injury-A case series from India and literature review. Hepatol Commun. 2023 Sep 27;7(10):e0270. DOI: 10.1097/HC9.0000000000000270
[3] Mikulska P, Malinowska M, Ignacyk M, Szustowski P, Nowak J, Pesta K, Szeląg M, Szklanny D, Judasz E, Kaczmarek G, Ejiohuo OP, Paczkowska-Walendowska M, Gościniak A, Cielecka-Piontek J. Ashwagandha (Withania somnifera)-Current Research on the Health-Promoting Activities: A Narrative Review. Pharmaceutics. 2023 Mar 24;15(4):1057. DOI: 10.3390/pharmaceutics15041057
[4] Tharakan A, Shukla H, Benny IR, Tharakan M, George L, Koshy S. Immunomodulatory Effect of Withania somnifera (Ashwagandha) Extract-A Randomized, Double-Blind, Placebo Controlled Trial with an Open Label Extension on Healthy Participants. J Clin Med. 2021 Aug 18;10(16):3644. DOI: 10.3390/jcm10163644
[5] Alanazi HH, Elfaki E. The immunomodulatory role of withania somnifera (L.) dunal in inflammatory diseases. Front Pharmacol. 2023 Feb 22;14:1084757. DOI: 10.3389/fphar.2023.1084757
[6] Guillevin L, Pagnoux C, Karras A, Khouatra C, Aumaître O, Cohen P, Maurier F, Decaux O, Ninet J, Gobert P, Quémeneur T, Blanchard-Delaunay C, Godmer P, Puéchal X, Carron PL, Hatron PY, Limal N, Hamidou M, Ducret M, Daugas E, Papo T, Bonnotte B, Mahr A, Ravaud P, Mouthon L; French Vasculitis Study Group. Rituximab versus azathioprine for maintenance in ANCA-associated vasculitis. N Engl J Med. 2014 Nov 6;371(19):1771-80. DOI: 10.1056/NEJMoa1404231