Deutscher Rheumatologiekongress 2025
Deutscher Rheumatologiekongress 2025
Neu aufgetretene oder rezidivierende Malignome in Patient:innen mit rheumatoider Arthritis und einer malignen Vorerkrankung in der Routineversorgung
Text
Einleitung: Rheumatoide Arthritis (RA) ist mit einem erhöhten Malignomrisiko assoziiert [1]. Bisherige Daten zeigen für RA-Patient:innen mit maligner Vorerkrankung, die mit biologischen (b) DMARDs (disease-modifying anti-rheumatic drugs) behandelt werden, kein erhöhtes Risiko neu aufgetretener Malignome gegenüber Patient:innen, die mit konventionell synthetischen (cs) DMARDs behandelt werden. Es bestehen Hinweise, dass Tumornekrosefaktor-Inhibitoren (TNFi) gegenüber csDMARDs ein reduziertes Malignomrisiko haben [2], [3]. Jedoch liegen für einige DMARD-Therapien keine Daten zur Entstehung von Malignomen nach einer früheren Krebserkrankung vor, z.B. für Interleukin-6 Inhibitoren (IL6i) oder Januskinase-Inhibitoren (JAKi). Ziel dieser Analyse war, in diesem Kontext die Auswirkungen von JAKi, TNFi, abatacept (ABA), rituximab (RTX), IL6i und csDMARDs auf das Risiko neu aufgetretener oder rezidivierender Malignome zu untersuchen.
Methoden: Untersucht wurden Daten von Patient:innen mit maligner Vorerkrankung, die zwischen 11/2006 und 12/2021 im RABBIT-Register eine DMARD-Therapie begonnen. Inzidenzraten (IR) neu aufgetretener oder rezidivierender Malignome (ohne nicht-melanotischen Hautkrebs, NMSC) pro 1.000 Patientenjahre (PJ) mit 95% Konfidenzintervallen (KI) wurden berechnet. Das Malignomrisiko wurde als Hazard ratios (HR) mittels Cox-Regression geschätzt, adjustiert durch inverse Wahrscheinlichkeitsgewichtung unter Berücksichtigung von relevanten Kovariablen (Tabelle 1 [Tab. 1]). Fehlende Werte wurden imputiert, Ereignisse den Therapien mittels des Prinzips „once exposed, always at risk“ bei einer 6-monatigen Latenzperiode zu Behandlungsbeginn zugeordnet.
Tabelle 1: Baseline-Charakteristika für Patient:innen mit malignen Vorerkrankungen bei Behandlungsbeginn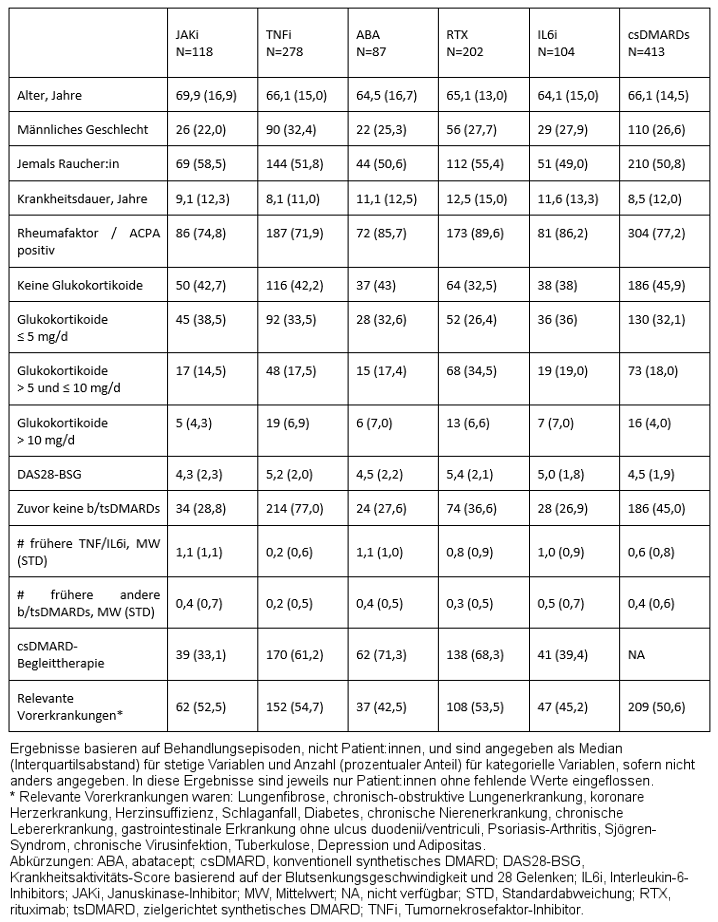
Ergebnisse: 118 JAKi-, 278 TNFi-, 87 ABA-, 202 RTX-, 104 IL6i- und 413 csDMARD-Behandlungsepisoden von insgesamt 706 Patient:innen wurden dokumentiert. JAK-Patient:innen waren im Mittel älter und rauchten häufiger als andere, während Patient:innen unter ABA, RTX and IL6i im Mittel eine längere Krankheitsdauer aufwiesen und häufiger RF/ACPA-positiv waren als andere. Patient:innen unter TNFi waren etwas häufiger männlich und hatten deutlich weniger DMARD-Vortherapien bekommen, besonders weniger TNFi und IL6i (Tabelle 1 [Tab. 1]).
127 Malignome traten auf, davon 14, 40, 9, 34, 17 und 70 jeweils unter JAKi, TNFi, ABA, RTX, IL6i und csDMARDs. IRs lagen zwischen 23 und 40 unter csDMARDs und JAKi (Tabelle 2 [Tab. 2]). Nach Adjustierung für verschiedene Patient:innencharakteristika wiesen im Vergleich zu TNFi keine DMARD-Wirkstoffprinzipien ein signifikant erhöhtes Malignomrisiko auf (Tabelle 2 [Tab. 2]).
Tabelle 2: Rohe Inzidenzraten und Hazard ratios für neu aufgetretene oder rezidivierende Malignome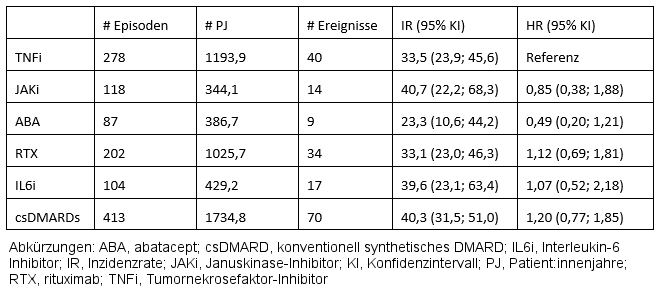
Schlussfolgerung: Die Analyse ergab keine statistischen Hinweise auf ein erhöhtes Risiko neu aufgetretener oder rezidivierender Malignome bei RA-Patient:innen unter verschiedenen DMARDs im Vergleich zu TNFi. Die Anzahl der aufgetretenen Malignome war jedoch gering und weitere Analysen sind erforderlich.
Literatur
[1] De Cock D, Hyrich K. Malignancy and rheumatoid arthritis: Epidemiology, risk factors and management. Best Pract Res Clin Rheumatol. 2018 Dec;32(6):869-86. DOI: 10.1016/j.berh.2019.03.011[2] Silva-Fernández L, Lunt M, Kearsley-Fleet L, Watson KD, Dixon WG, Symmons DP, Hyrich KL; British Society for Rheumatology Biologics Register (BSRBR) Control Centre Consortium. The incidence of cancer in patients with rheumatoid arthritis and a prior malignancy who receive TNF inhibitors or rituximab: results from the British Society for Rheumatology Biologics Register-Rheumatoid Arthritis. Rheumatology (Oxford). 2016 Nov;55(11):2033-9. DOI: 10.1093/rheumatology/kew314
[3] Xie W, Xiao S, Huang Y, Sun X, Gao D, Ji L, Li G, Zhang Z. A meta-analysis of biologic therapies on risk of new or recurrent cancer in patients with rheumatoid arthritis and a prior malignancy. Rheumatology (Oxford). 2020 May 1;59(5):930-39. DOI: 10.1093/rheumatology/kez475




