Deutscher Rheumatologiekongress 2025
Deutscher Rheumatologiekongress 2025
Kritische Auswirkungen auf die kardiale Funktion: Baseline-NT-proBNP und -LVEF als prognostische Biomarker der eosinophilen Kardiomyopathie
Text
Einleitung: Die kardiale Beteiligung ist eine vital bedrohliche Manifestation Eosinophilie-assoziierter Erkrankungen wie der eosinophilen Granulomatose mit Polyangiitis (eGPA) und anderer hypereosinophiler Syndrome (HES) [1]. Aufgrund der Seltenheit existieren weder geeignete Biomarker noch standardisierte Behandlungsempfehlungen. Unsere Arbeitsgruppe konnte in präliminären Daten das Baseline-NT-proBNP im Serum als potentiellen Biomarker identifizieren [2]. Hier bestätigen und erweitern wir unsere Beobachtungen an der Münchener Gesamtkohorte.
Methoden: Daten der klinischen Routineversorgung von 52 Patienten mit Kardiomyopathie bei zugrundeliegender eGPA, HES sowie Medikamenten-induzierter-/Hypersensitivitätsmyokarditis, die zwischen 2010 und 2024 erstmals in unserer Klinik behandelt wurden, wurden retrospektiv analysiert. Die mediane Nachbeobachtung belief sich auf 34 Patientenmonate.
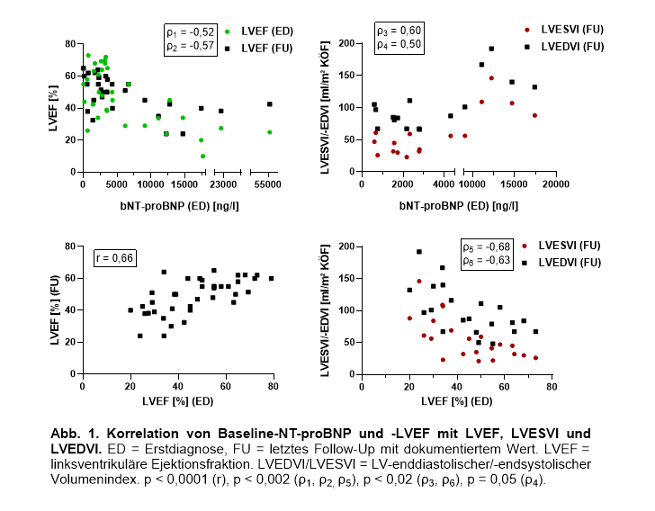
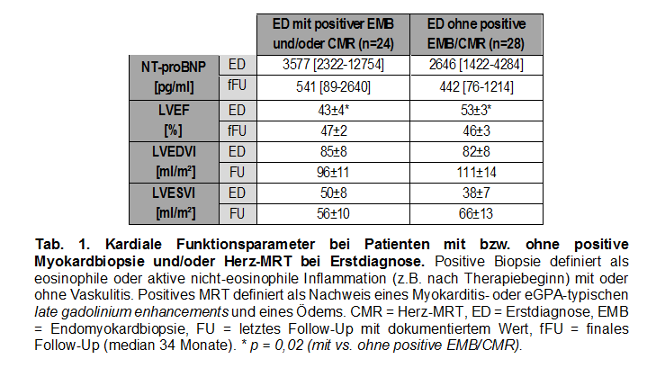
Ergebnisse: Bei 52 Patienten (50% weiblich, Alter 51,5 [37,3–59,8] Jahre) wurde 30-mal eine eGPA, 16-mal ein idiopathisches HES, 7-mal eine Medikamenten-induzierte/Hypersensitivitätsmyokarditis (davon 4-mal bekannte eGPA/HES) und 3-mal ausschließlich eine eosinophile Myokarditis diagnostiziert. Bei Erstdiagnose (ED) vs. nach median 34 Monaten lag die linksventrikuläre Auswurffraktion (LVEF) bei 48±2% (25/49 <50%) vs. 46±2% (19/37 <50%) und das Serum-NT-proBNP bei 3.283 [1.692–9.600] vs. 443 [88–1264] pg/ml. Der LV-endsystolische bzw. -enddiastolische Volumenindex (LVEDVI/LVESVI) bei ED vs. dem letzten Follow-Up mit dokumentiertem Wert (FU) betrug 45±5 bzw. 84±6 ml/m² vs. 60±8 bzw. 102±8 ml/m². Baseline-NT-proBNP und -LVEF korrelierten im Gegensatz zu CRP, Troponin, Kreatinkinase und Eosinophilenzahl nicht nur mit der Baseline-LVEF, sondern auch mit der Follow-Up-LVEF, -LVEDVI und -LVESVI (Abbildung 1 [Fig. 1]). Ebenfalls korrelierte ein 2022 publizierter eGPA-Kardiomyopathie-Score (Sartorelli et al.) mit der FU-LVEF, nicht jedoch der revisited Five Factor Score [3], [4]. Patienten, bei denen die Diagnose mit vs. ohne (positive) Myokardbiopsie und/oder Herz-MRT gestellt wurde, hatten bei ED eine signifikant schlechtere Pumpfunktion, die sich bis zum Follow-Up jedoch besser erholte (Tabelle 1 [Tab. 1]).
Schlussfolgerung: Wir identifizieren hier das Baseline-NT-proBNP und die Baseline-LVEF als prognostische Biomarker für die Entwicklung der kardialen Funktion bei eosinophilen Erkrankungen. Auch klinische Composite-Scores könnten perspektivisch genutzt werden. Eine persistierende Einschränkung der LVEF und deutliche LV-Dilatation im Verlauf zeigt sich selbst bei Patienten ohne positive Myokardbiopsie/Herz-MRT bei ED. Wir schlagen deshalb den Begriff „Eosinophilie-assoziierte Kardiomyopathie“ vor.
Ob eine Biopsie/MRT aggressivere Therapien bahnt und damit kardiale Parameter verbessert, bleibt wie die Rolle einer gezielten Herzinsuffizienz- bzw. Biomarker-gesteuerten Therapie zu klären. Letztlich ist die kardiale Funktionsverbesserung für die Eosinophilie-assoziierte Kardiomyopathie entscheidend.
References
[1] Brambatti M, Matassini MV, Adler ED, Klingel K, Camici PG, Ammirati E. Eosinophilic Myocarditis: Characteristics, Treatment, and Outcomes. J Am Coll Cardiol. 2017 Nov 7;70(19):2363-75. DOI: 10.1016/j.jacc.2017.09.023[2] Ullrich FTH, Murray A, Grabmaier U, et al. Eosinophile Myokarditis – auf der Suche nach Biomarkern: Charakteristika, Therapien und kardiales Outcome einer neu etablierten Münchener Universitätskohorte. Deutscher Rheumatologiekongress 2024. Düsseldorf, Germany: German Medical Science GMS Publishing House; 2024.
[3] Sartorelli S, Chassagnon G, Cohen P, Dunogué B, Puéchal X, Régent A, Mouthon L, Guillevin L, Terrier B; French Vasculitis Study Group (FVSG). Revisiting characteristics, treatment and outcome of cardiomyopathy in eosinophilic granulomatosis with polyangiitis (formerly Churg-Strauss). Rheumatology (Oxford). 2022 Mar 2;61(3):1175-84. DOI: 10.1093/rheumatology/keab514
[4] Guillevin L, Pagnoux C, Seror R, Mahr A, Mouthon L, Toumelin PL; French Vasculitis Study Group (FVSG). The Five-Factor Score revisited: assessment of prognoses of systemic necrotizing vasculitides based on the French Vasculitis Study Group (FVSG) cohort. Medicine (Baltimore). 2011 Jan;90(1):19-27. DOI: 10.1097/MD.0b013e318205a4c6