Deutscher Rheumatologiekongress 2025
Deutscher Rheumatologiekongress 2025
Vergleich der Entwicklung der Lungenfunktion bei Patienten mit SSc-ILD unter Tocilizumab, Rituximab und Mycophenolatmofetil in Deutschland. Eine DNSS-Analyse
Text
Einleitung: Basierend auf positiven Studiendaten [1], [2] folgte 2021 die FDA Zulassung für Tocilizumab (TCZ) zur Behandlung der interstitiellen Lungenerkrankung (ILD) bei Patienten mit systemischer Sklerose (SSc). Auch aktuelle europäische Empfehlungen zur Behandlung der SSc befürworten den Einsatz von TCZ [3]. In Deutschland kann TCZ nur als off-label Therapie nach entsprechender Beantragung und Genehmigung der Krankenkasse eingesetzt werden.
Die Real-World-Evidenz (RWE) zur Anwendung von TCZ bei SSc-ILD ist sehr limitiert, sodass nun in dieser Arbeit eine Analyse der Wirkung von TCZ im Vergleich zu Mycophenolatmofetil (MMF) und Rituximab (RTX) basierend auf den Daten des Deutschen Netzwerks für systemische Sklerodermie (DNSS) - Registers erfolgte.
Methoden: Es wurde ein Vergleich der Lungenfunktionsparameter einer neu begonnenen Therapie zwischen TCZ, RTX und MMF durchgeführt. Analysiert wurden Patienten aus dem DNSS Register, für die eine Reihe von drei Untersuchungen (inkl. Lungenfunktionsdiagnostik), davon eine ohne Therapie (d.h. ohne Immunsuppression/Antifibrotikum) gefolgt von mindestens zwei mit Therapie, dokumentiert wurde. Patienten mit mehrfacher Therapie (z.B. MMF, dann RTX) wurden nur berücksichtigt, wenn der Abstand zwischen den Therapien mindestens ein Jahr betrug. Patienten mit gleichzeitiger Behandlung von zwei untersuchten Substanzen wurden ausgeschlossen. Die Änderung der Lungenfunktion (FVC% und DLOCI) im Vergleich zur Baseline wurde als Verhältnis zur Ausgangsmessung (letzte Untersuchung ohne Therapie) berechnet. Es erfolgte eine deskriptive Statistik aufgrund der geringen Anzahl an untersuchten Patienten in der RTX- und TCZ-Gruppe.
Ergebnisse: Von 834 Patienten mit SSc-ILD mit im Median 5 Visiten konnten insgesamt 86 Patienten in die Analyse eingeschlossen werden (nMMF = 73, nRTX=7, nTCZ=6).
Die klinischen Merkmale der untersuchten Patienten sind in Tabelle 1 [Tab. 1] dargestellt. Es zeigt sich, dass Patienten, die mit RTX und TCZ behandelt werden, häufiger eine dcSSc aufweisen. Des Weiteren ist die Baseline-DLCO bei Patienten unter TCZ geringer.
Tabelle 1: Baseline Charakteristika der Patienten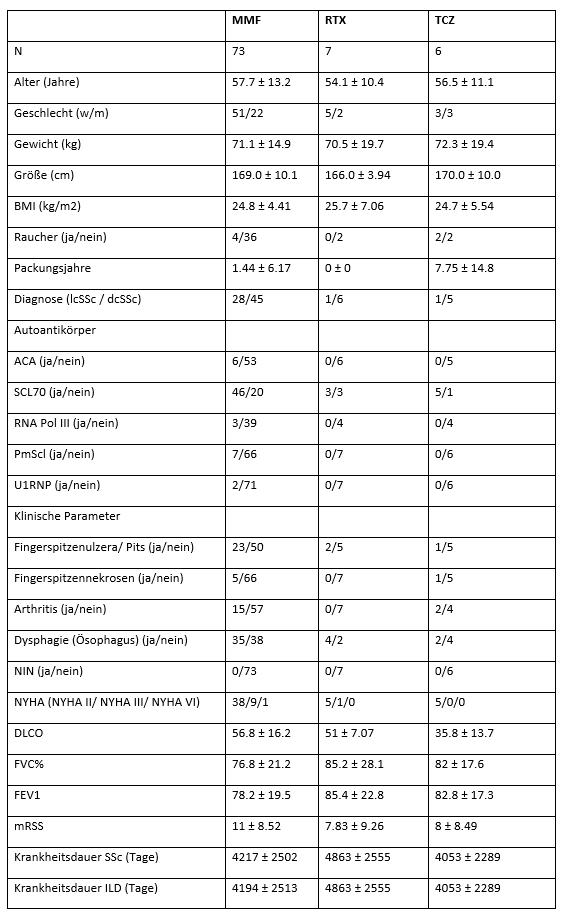
Unter allen drei Präparaten kam es im untersuchten Zeitraum zu keiner Verschlechterung der Lungenfunktionsparameter (Tabelle 2 [Tab. 2]). Es konnte kein relevanter Unterschied in den Werten der geschätzten forcierten Vitalkapazität (FVC %) oder der Diffusionskapazität für Kohlenmonoxid (DLCO) über einen Zeitraum von drei Jahren zwischen den Patientengruppen festgestellt werden, die neu entweder mit MMF, RTX oder TCZ behandelt wurden.
Tabelle 2: Entwicklung der Lungenfunktionsparameter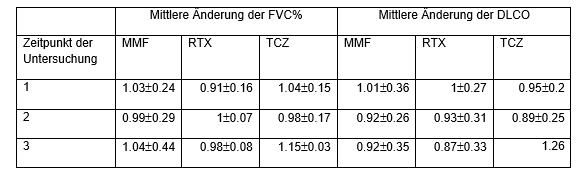
Schlussfolgerung: In dieser Kohorte von SSc-ILD Patienten des DNSS-Registers zeigte sich- bei begrenzten Fallzahl – eine vergleichbare Entwicklung der Lungenfunktion (FVC%, DLCO) unter Therapie mit MMF, RTX und TCZ.
References
[1] Khanna D, Denton CP, Lin CJF, van Laar JM, Frech TM, Anderson ME, Baron M, Chung L, Fierlbeck G, Lakshminarayanan S, Allanore Y, Pope JE, Riemekasten G, Steen V, Müller-Ladner U, Spotswood H, Burke L, Siegel J, Jahreis A, Furst DE. Safety and efficacy of subcutaneous tocilizumab in systemic sclerosis: results from the open-label period of a phase II randomised controlled trial (faSScinate). Ann Rheum Dis. 2018 Feb;77(2):212-20. DOI: 10.1136/annrheumdis-2017-211682[2] Khanna D, Lin CJF, Furst DE, Goldin J, Kim G, Kuwana M, Allanore Y, Matucci-Cerinic M, Distler O, Shima Y, van Laar JM, Spotswood H, Wagner B, Siegel J, Jahreis A, Denton CP; focuSSced investigators. Tocilizumab in systemic sclerosis: a randomised, double-blind, placebo-controlled, phase 3 trial. Lancet Respir Med. 2020 Oct;8(10):963-74. DOI: 10.1016/S2213-2600(20)30318-0
[3] Del Galdo F, Lescoat A, Conaghan PG, Bertoldo E, Čolić J, Santiago T, Suliman YA, Matucci-Cerinic M, Gabrielli A, Distler O, Hoffmann-Vold AM, Castellví I, Balbir-Gurman A, Vonk M, Ananyeva L, Rednic S, Tarasova A, Ostojic P, Boyadzhieva V, El Aoufy K, Farrington S, Galetti I, Denton CP, Kowal-Bielecka O, Mueller-Ladner U, Allanore Y. EULAR recommendations for the treatment of systemic sclerosis: 2023 update. Ann Rheum Dis. 2025 Jan;84(1):29-40. DOI: 10.1136/ard-2024-226430




