Deutscher Rheumatologiekongress 2025
Deutscher Rheumatologiekongress 2025
Wirkung der Anti-CD19-CAR-T-Zelltherapie im Knochenmark von Patienten mit systemischen Autoimmunerkrankungen
Text
Einleitung: Die Anti-CD19-T-Zelltherapie mit chimären Antigenrezeptoren (CAR) hat sich als vielversprechende Behandlungsoption für Patienten mit systemischen Autoimmunerkrankungen erwiesen, die auf Standardtherapien nicht ansprechen [1]. Es wird angenommen, dass ihre Wirksamkeit auf ihrer Fähigkeit beruht, B-Zellen im Gewebe zu eliminieren. Aktuelle Ergebnisse haben gezeigt, dass eine Anti-CD19-CAR-T-Zelltherapie B-Zellen in den Lymphknoten von Patienten mit systemischen Autoimmunerkrankungen wirksam eliminiert [2]. Allerdings bedarf es weiterer Forschung, um die langfristigen Auswirkungen dieser Therapie auf das Knochenmark bei diesen Krankheitsbildern zu evaluieren.
Methoden: Drei Patienten mit schweren, behandlungsresistenten systemischen Autoimmunerkrankungen (Tabelle 1 [Tab. 1]) erhielten eine autologe Anti-CD19-CAR-T-Zelltherapie (KYV-101, Kyverna Therapeutics, Emeryville, CA, USA) nach einer Konditionierungstherapie mit Fludarabin und Cyclophosphamid [3], [4]. Knochenmarkbiopsien wurden vor der Therapie (Patienten 2 und 3) und nach der Therapie (Patient 1 und 2 in Woche 16 und Patient 3 in Woche 7) durchgeführt. Die Immunphänotypisierung von B- und T-Zellen wurde mittels Durchflusszytometrie durchgeführt.
Tabelle 1: Patientencharakteristiken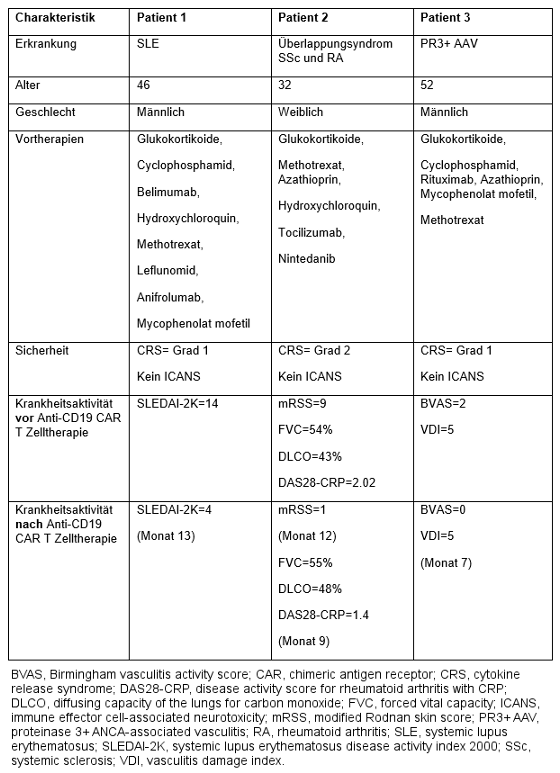
Ergebnisse: Die Behandlung mit KYV-101 erwies sich als sicher (Tabelle 1 [Tab. 1]). Nach der Anti-CD19-CAR-T-Zelltherapie wurde eine stabile klinische Verbesserung erreicht, selbst nach Absetzen aller anderen immunsuppressiven Behandlungen. Bei zwei Patienten (Patienten 1 und 3) wurden vor der peripheren B-Zell-Rekonstitution Knochenmarksbiopsien durchgeführt. Bei diesen Patienten waren die B-Zellen, insbesondere CD19+ Plasmablasten und CD19+ Plasmazellen, in Woche 16 bzw. 7 deutlich reduziert. Im Gegensatz dazu wurde die Knochenmarksbiopsie bei Patient 2 nach der B-Zell-Rekonstitution durchgeführt. In Woche 16, nach der Anti-CD19-CAR-T-Zelltherapie und nach der B-Zell-Rekonstitution, wiesen die B-Zellen im Knochenmark von Patient 2 überwiegend einen naiven/Übergangsphänotyp auf, was auf das erneute Auftreten von naiven/Übergangs-B-Zellen hindeutet. Darüber hinaus waren Gedächtnis-B-Zellen vermindert, und CD19+ Plasmablasten und Plasmazellen waren deutlich reduziert.
Schlussfolgerung: Diese Studie unterstreicht, dass die Anti-CD19-CAR-T-Zelltherapie in Kombination mit Konditionierungstherapie die Remission bei Patienten mit systemischen Autoimmunerkrankungen fördert, indem sie die B-Zellen in den primären lymphatischen Organen vollständig dezimiert.
References
[1] Müller F et al. CD19 CAR T-Cell Therapy in Autoimmune Disease — A Case Series with Follow-up. N Engl J Med. 2024;390(8):687-700. DOI: 10.1056/NEJMoa2308917[2] Tur C et al. CD19-CAR T-cell therapy induces deep tissue depletion of B cells. Annals of the Rheumatic Diseases. 2025 Jan;84(1):106-14. DOI: 10.1136/ard-2024-226142
[3] Minopoulou I, Wilhelm A, Albach F, Kleyer A, Wiebe E, Schallenberg S, Fleischmann A, Frick M, Damm F, Gogolok J, Serve S, Locher BN, Borie D, Casteleyn V, Biesen R, Dörner T, Alexander T, Zernicke J, Movassaghi K, Hütter-Krönke ML, Schrezenmeier E, Schreiber A, Schneider U, Bullinger L, Krönke G, Penack O, Simon D. Anti-CD19 CAR T cell therapy induces antibody seroconversion and complete B cell depletion in the bone marrow of a therapy-refractory patient with ANCA-associated vasculitis. Ann Rheum Dis. 2025 Mar;84(3):e4-e7. DOI: 10.1016/j.ard.2025.01.008
[4] Albach FN, Minopoulou I, Wilhelm A, Biesen R, Kleyer A, Wiebe E, Fleischmann A, Frick M, Damm F, Gogolok J, Serve S, Locher BN, Borie D, Casteleyn V, Siegert E, Dörner T, Alexander T, Furth C, Zernicke J, Movassaghi K, Hütter-Krönke ML, Schrezenmeier E, Schneider U, Bullinger L, Krönke G, Penack O, Simon D. Targeting autoimmunity with CD19-CAR T-cell therapy: efficacy and seroconversion in diffuse systemic sclerosis and rheumatoid arthritis. Rheumatology (Oxford). 2025 Jun 1;64(6):4075-7. DOI: 10.1093/rheumatology/keaf077




