German Congress of Orthopaedics and Traumatology (DKOU 2025)
Deutscher Kongress für Orthopädie und Unfallchirurgie 2025 (DKOU 2025)
Patientenindividuelle 3D-gedruckte Polycaprolacton-Scaffolds in Kombination mit bioaktivem Glas – ist das die Zukunft in der Therapie großer Knochendefekte?
Text
Zielsetzung und Fragestellung: Die Therapie nach Masquelet stellt neben der Distraktionsosteogenese den Goldstandard in der Versorgung großer Knochendefekte dar. Eine entscheidende Limitation ist allerdings die begrenzte Menge an autologem Knochengraft. Insbesondere in großen Knochendefekten kommt es außerdem durch lockeres Platzieren des Grafts im Defekt häufig zu einem schwerkraftbedingten Absinken und Mikrobewegungen und infolgedessen zu einer verminderten Neoangiogenese und Konsolidierungsproblemen am proximalen Defektende. Die Kombination von patientenindividuell 3D-gedruckten Polycaprolacton- (PCL-) Scaffolds, die innerhalb von 2–3 Jahren resorbiert werden, mit autologer Spongiosa und bioaktivem Glas (BaG) als Graftexpander verspricht eine Reduktion des schwerkraftbedingten Absinkens, Mikrobewegungen und benötigen Graftmaterials. Diese Studie untersucht deshalb die Neovaskularisation des Grafts, die knöcherne Konsolidierung und verschiedene Lebensqualitäts- und Funktionsparameter bei der Verwendung von PCL-Scaffolds und BaG in der Masquelet-Therapie großer Knochendefekte.
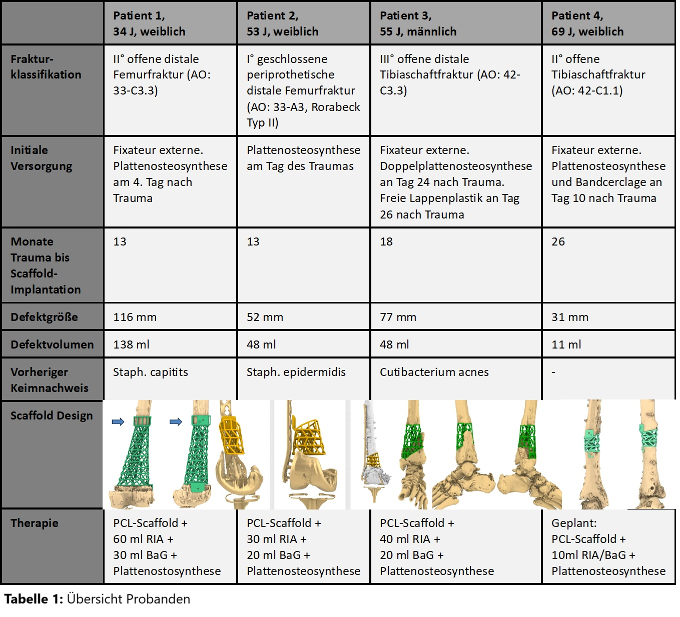
Material und Methoden: In diese monozentrische, prospektive Studie wurden zum Zeitpunkt der Abstract-Einreichung 4 Patienten (Pat.) mit großen Knochendefekten der unteren Extremität mit patientenindividuellen 3D-gedruckten PCL-Scaffolds, autologer Knochentransplantation mit Femurmarkraumaspirat (RIA), sowie BaG als Graftexpander eingeschlossen (Tabelle 1 [Tab. 1]). Die Nachsorge erfolgte 1, 6, 12 Wochen (Wo), sowie 6, 12 und 24 Monate (Mo) postoperativ (po). Knöcherne Konsolidierung wurde mittels Röntgen (bis inkl. 12 Wo po) und CT (ab 6 Mo po) bewertet. Graftperfusion und Neoangiogenese wurde mit kontrastmittelverstärktem Ultraschall (CEUS) und kontrastmittelverstärktem MRT (DCE-MRT) beurteilt. Außerdem wurden Fragebögen zur Lebensqualität (SF-12, EQ-5D-5L, Schmerzen) und Mobilität (lower extremity function score; LEFS), Blutanalysen, Wiederaufnahme der Arbeit und Zeitpunkt der Vollbelastung beurteilt. Insgesamt sollen 20 Pat. eingeschlossen werden.
Ergebnisse: Bei allen Pat. wurde in CEUS (6, 12 Wo, 6 Mo po) und DCE-MRT (12 Wo, 6 Mo po) eine vermehrte Graftperfusion im Vergleich zum Referenzgewebe festgestellt Abbildung 1 [Abb. 1], Tabelle 2 [Tab. 2]). Die radiologischen Verlaufsaufnahmen zeigten eine zufriedenstellende knöcherne Konsolidierung (Tabelle 2 [Tab. 2]). Klinische Scores beschrieben bei allen Pat. verbesserte Lebensqualität und Funktion (SF-12, EQ-5D-5L, Schmerzlevel, LEFS), sowie eine Vollbelastung nach 12 Wochen (Tabelle 2 [Tab. 2]). Als unerwünschtes Ereignis wurde eine transfusionspflichtige postoperative Anämie detektiert.
Diskussion und Schlussfolgerung: Unsere vorläufigen Daten zeigen, dass patientenindividuell 3D-gedruckte PCL-Scaffolds in Kombination mit BaG in der Therapie von großen Knochendefekten das benötigte Graftmaterial um 28–56% reduzieren und gute klinische und radiologische Resultate erzielen konnten. Sollten sich diese Ergebnisse bestätigen, können 3D-gedruckte patientenindividuelle PCL-Scaffolds in Kombination mit BaG die Masquelet Therapie entscheidend erweitern, um Heilungsraten bei großen Knochendefekten weiter zu verbessern.