German Congress of Orthopaedics and Traumatology (DKOU 2025)
Deutscher Kongress für Orthopädie und Unfallchirurgie 2025 (DKOU 2025)
Zellfreie Tumor-DNA bei Chondrosarkom-Patienten: Eine prospektive prä- und postoperative Analyse
Text
Zielsetzung und Fragestellung: Chondrosarkome (CS) sind aufgrund fehlenden Ansprechens auf Chemo-/Strahlentherapie mit schlechtem Überleben assoziiert und stellen therapeutische Herausforderungen dar. IDH1/2, TP53, PIK3R1 und TERT-Promotor Mutationen sind häufige genomische Alterationen in CS. Der Nachweis CS-assoziierter Mutationen im Blut betroffener Patienten könnte bei Therapieplanung/-monitoring sowie Prognosebeurteilung hilfreich sein. In dieser prospektiven Arbeit haben wir prä- und postoperativ die ctDNA (cell-free tumor DNA) im Blut von CS-Patienten extrahiert und auf CS-spezifische Mutationen untersucht.
Material und Methoden: Es wurden 18 Patienten (männlich/weiblich: 12/6) mit CS oder Enchondrom eingeschlossen. Bei allen Patienten wurde im Biopsie-Tumorgewebe mittels Next Generation Sequencing eine der folgenden Mutationen nachgewiesen: IDH1/2, TP53, PIK3R1 oder TERT-Promotor. Danach erfolgte der prospektive Studieneinschluss mit seriellen Blutentnahmen unmittelbar präoperativ, am 5. postoperativ Tag sowie im Rahmen der Tumornachsorgen (3, 6, 9 Monate postoperativ).
Ergebnisse: Das mediane Alter der Patienten betrug 59 Jahre (27–89). Histologisch handelte es sich um Enchondrome (n=3), G1-CS/atypisch kartilaginäre Tumoren (ACT) (n=5), G2-CS (n=7), G3-CS (n=1) und dediff. CS (n=2). Die Tumoren waren an unterer (n=7) bzw. oberer Extremität (n=5), Sakrum (n=2) oder Becken (n=4) lokalisiert. Das mediane Tumorvolumen betrug 79,9 (1,9–1,332,9) cm3. Eine IDH-Mutation konnte im Tumorgewebe bei 15 Patienten nachgewiesen werden (IDH1: n=12, IDH2: n=3), die TERT-Promotor bei 4 Patienten sowie eine TP53- oder PIK3R1-Mutation bei je 3 Patienten. Die IDH1-Mutation konnte bei 6 Patienten (40%) direkt im Blut nachgewiesen werden, jedoch keine IDH2-Mutation. Des Weiteren gelang der Nachweis einer TP53- und TERT-Promotor Mutation in einem Fall (Tabelle 1 [Tab. 1]). Die Sensitivität des ctDNA-Nachweises der IDH-Mutation lag bei 40% und die Spezifität bei 100%. Ein signifikanter Zusammenhang zwischen ctDNA-Nachweis und erhöhtem Patientenalter, Tumorlokalisation, -grading oder -größe bestand nicht. Eine Korrelation zwischen ctDNA-Nachweis im Blut und Patientenprognose (krankheitsspezifisches/progressionsfreies Überleben) konnte nicht nachgewiesen werden.
Tabelle 1: Patientencharakteristika – ctDNA-Nachweis der IDH-Mutation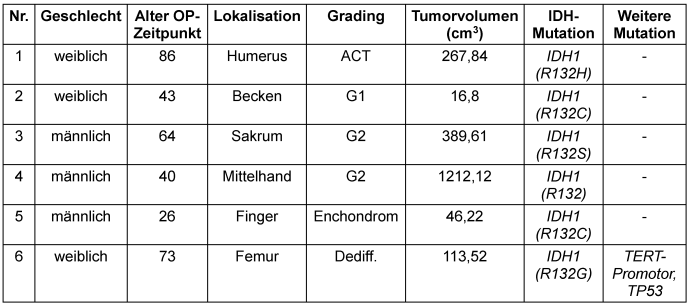
Diskussion und Schlussfolgerung: Der Nachweis der ctDNA genomischer Alterationen, insbesondere der IDH-Mutation, im Blut von CS-Patienten ist hochspezifisch. Der ctDNA-Nachweis sowie eine praxisrelevante Sensitivität – und damit potenzielle Assoziation mit der Prognose (perspektivisch Biomarker) – müssen anhand größerer Fallzahlen in prospektiven, multizentrischen Studien validiert werden.




