German Congress of Orthopaedics and Traumatology (DKOU 2025)
Deutscher Kongress für Orthopädie und Unfallchirurgie 2025 (DKOU 2025)
Zellen der mesenchymal-osteoblastären Linie sind resistent gegen Inhibition der Integrin α2 Expression durch Ropivacain und E7820: Implikationen für ihre Anwendung in muskuloskelettaler Regeneration
Text
Zielsetzung und Fragestellung: Muskuloskelettale Gesundheit ist für Funktionsfähigkeit und Lebensqualität essenziell. Integrin α2 ist ein vielversprechendes Ziel zur Behandlung muskuloskelettaler Regeneration, da wir zeigen konnten, dass Integrin α2 Defizienz zu beschleunigter Osteoblastendifferenzierung und Frakturheilung führt, sowie vor Osteoporose schützt. Ropivacain und E7820 sind in anderen Zelllinien als Inhibitoren der Integrin α2 Expression vorbeschrieben. Ropivacain wurde außerdem als Inhibitor des kanonischen Integrin α2 Signalweges via Fokal Adhesion Kinase (FAK) beschrieben. Ziel dieser Untersuchung war die Evaluation dieser Substanzen als Therapeutica im Rahmen muskuloskelettaler Erkrankungen durch die Inhibierung von Integrin α2.
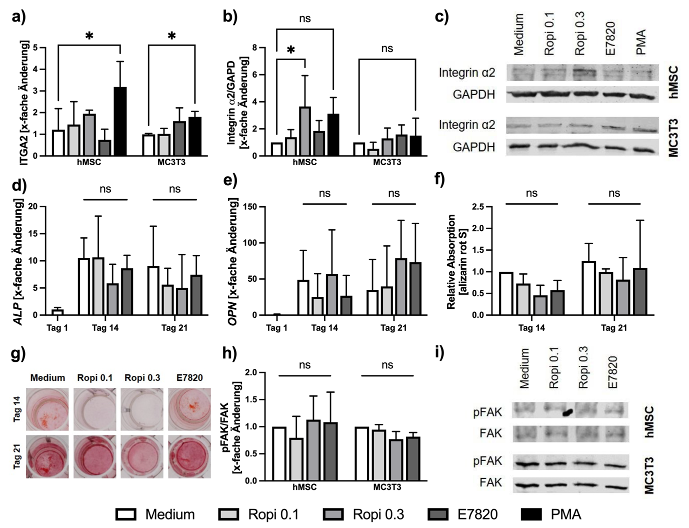
Material und Methoden: Primäre humane mesenchymale Stammzellen (hMSC) wurden aus perioperativ reseziertem Knochen isoliert (Ethikvotums 2021-625-f-S). hMSCs und murine prä-osteoblastäre MC3T3 Zellen wurden mit 0,1 und 0,3 mg/ml Ropivacain oder 50ng/ml E7820 in Kulturmedium oder in osteoblastärem Differenzierungsmedium kultiviert. Der Phorbolester PMA wurde als Kontrolle zur Induktion der Integrin α2 Expression verwendet. Toxizität wurde mittels einem MTT-Assay und Integrin α2 Expression mittels qPCR und Western Blot (WB) analysiert. Osteoblastäre Differenzierung wurde mittels qPCR für Alkalische Phosphatase (ALP) und Osteopontin (OPN) sowie mittels Alizarin Rot-S Färbung der Kalzifizierung evaluiert. Der FAK Signalweg wurde mittels phosphorylierungs-spezifischen Immunoblottingmethoden analysiert. Statistische Auswertung erfolgte mittels ANOVA und multiplem Testen mit der Holm- Šídák Methode in GraphPad Prism (Version 10.4.1). p≤0,05 (*) wurde als signifikant betrachtet.
Ergebnisse: Im MTT-Assay zeigten sich die Testkonzentrationen der Substanzen als nicht toxisch. Sowohl in der qPCR nach 24 Stunden als auch im WB nach 72 Stunden zeigte sich für Ropivacain und E7820 nicht die erwartete Inhibierung der Integrin α2 Expression (Abbildung 1 a-c [Fig. 1], minimum p=0.79), sondern tendenziell ein Anstieg. PMA zeigte in beidem den erwarteten Anstieg der Integrin α2 Expression (p=0.04). Sowohl Ropivacaine als auch E7820 zeigten keinen signifikanten Effekt auf die Expression der Differenzierungsmarker ALP und OPN (p=0.43 und 0.54, Abbildung 1 d+e [Fig. 1]), oder auf die Kalzifizierung (p=0.28, Abbildung 1 f+g [Fig. 1]) nach 14 und 21 Tagen. Tendenziell zeigte sich eine Reduktion der osteoblastären Differenzierung durch Ropivacain und E7820. Die Analyse des kanonischen Integrin α2 Signalwegs via FAK-phosphorylierung (pFAK) zeigte keine signifikante Veränderung des pFAK/FAK Verhältnisses nach 72 Stunden durch die Substanzen (p=0.85, Abbildung 1 h+i [Fig. 1]).
Diskussion und Schlussfolgerung: Bei humanen osteoblastären Zellen zeigten Ropivacain und E7820 keine Inhibition der Integrin α2 Expression oder vom kanonischem Integrin α2 Signalweg via FAK. Die Daten deuten auf eine Zelltyp-spezifische Funktionsweise der Regulation der Integrin α2 Expression hin. Ropivacain und E7820 sind daher nicht geeignet, den osteoprotektiven Phänotyp der Integrin α2 Defizienz pharmakologisch auszunutzen und Integrin α2 im Knochen zu inhibieren.