Deutscher Rheumatologiekongress 2025
Deutscher Rheumatologiekongress 2025
Wirksamkeit von CD19 CAR T-Zell Therapie bei therapierefraktärer rheumatoider Arthritis
Text
Einleitung: Trotz aller therapeutischen Fortschritte in den letzten Jahrzehnten leidet eine Anzahl von Patienten weiterhin an therapierefraktärer, schwer behandelbarer rheumatoider Arthritis (difficult to treat rheumatoid arthritis, D2T-RA). Innovative Behandlungen wie die chimäre CD19-Antigenrezeptor (CAR) T-Zelltherapie könnten ein wichtiger Schritt hin zu einer nachhaltigen Behandlungsstrategie sein [1], [2], [3].
Methoden: Ein 70-jähriger Patient mit chronisch aktiver, hoch seropositiver und erosiver D2T RA (Erstdiagnose vor 20 Jahren) erhielt im Rahmen eines individuellen Heilversuchs eine intravenöse Behandlung mit CD19 CAR T-Zellen (KYV-101, Kyverna Therapeutics, Emeryville, CA, USA) nach einer dreitägigen Lymphodepletion mit 30 mg/m2 Fludarabin und 300 mg/m2 Cyclophosphamid.
Ergebnisse: Trotz langjähriger Behandlung mit Glukokortikoiden und sequentieller Therapie mit 3 konventionellen und 10 zielgerichteten DMARDs inklusive Rituximab hatte der Patient zu keinem Zeitpunkt eine anhaltende Remission erreichen können. Unter Therapie mit Golimumab, Sulfasalazin und 5 mg/Tag Prednisolon war die Erkrankung weiterhin aktiv (DAS28-BSG von 5,46, Abbildung 1 [Fig. 1]). Nach Infusion der CD19 CAR T-Zelltherapie trat ein Zytokinfreisetzungssyndrom (Grad II) auf, welches sich innerhalb von 7 Tagen nach Behandlung mit Tocilizumab und Dexamethason vollständig zurückbildete. Weder ICANS noch Neutropenie traten auf. Die Anzahl der CD19 CAR T-Zellen stieg im Blut rasch an und erreichte am 10. Tag ihren Höhepunkt (384,22 CAR-T/µl; 31,51% der gesamten CD3-Zellen), bevor sie langsam innerhalb der nächsten 12 Wochen absank. Die B-Zellen im peripheren Blut sanken rasch ab und zeigten eine beginnende Rekonstitution ab Woche 16. Antikörper gegen citrullinierte Proteine (ACPAs) und Rheumafaktor-IgM/IgA gingen nach der Therapie zurück, blieben aber erhöht (vor Therapie vs 20 Wochen nach Therapie: ACPA 1892 vs 721 U/ml; RF IgM 1697 vs 184 U/ml; RF IgA 576 vs 86 U/ml), während die Immunglobuline G, M und A innerhalb normaler Grenzen blieben und die Impfantikörper (Varizella, Masern, Röteln) positiv blieben. Die Krankheitsaktivität der RA ging nach der CAR-T-Zelltherapie trotz Beendigung der Immunsuppression rasch und bis zum letzten Beobachtungszeitpunkt an Woche 20 anhaltend zurück (DAS28-BSG 1.97). Das Abklingen der Arthritis wurde durch die Bildgebung bestätigt (Abbildung 1 [Fig. 1]).
Abbildung 1: Die maximum intensity projections der Ga68-FAPI PET/CT Bildgebung zeigen vor CD19 CAR T-Zell Therapie eine deutliche Vermehrung der FAPI-Aufnahme in den Gelenken (Kreise) als Hinweis auf Arthritis und eine signifikante Verringerung 12 Wochen nach Therapie. 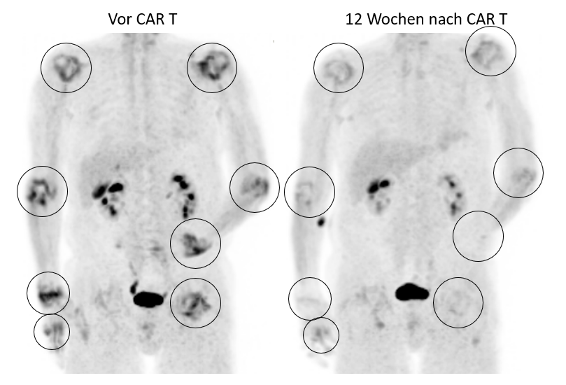
Schlussfolgerung: Dieser Fall unterstreicht das Potenzial der CD19 CAR-T Zelltherapie als eine sichere und wirksame Behandlungsoption für Patienten mit ACPA-positiver D2T-RA.
Literatur
[1] Albach FN, Minopoulou I, Wilhelm A, Biesen R, Kleyer A, Wiebe E, Fleischmann A, Frick M, Damm F, Gogolok J, Serve S, Locher BN, Borie D, Casteleyn V, Siegert E, Dörner T, Alexander T, Furth C, Zernicke J, Movassaghi K, Hütter-Krönke ML, Schrezenmeier E, Schneider U, Bullinger L, Krönke G, Penack O, Simon D. Targeting autoimmunity with CD19-CAR T-cell therapy: efficacy and seroconversion in diffuse systemic sclerosis and rheumatoid arthritis. Rheumatology (Oxford). 2025 Jun 1;64(6):4075-7. DOI: 10.1093/rheumatology/keaf077[2] Lidar M, Rimar D, David P, Jacoby E, Shapira-Frommer R, Itzhaki O, Slobodin G, Stern MD, Eshed I, Sanalla T, Marcus R, Shimoni A, Yerushalmi R, Shem Tov N, Danylesko I, Avigdor A. CD-19 CAR-T cells for polyrefractory rheumatoid arthritis. Ann Rheum Dis. 2025 Feb;84(2):370-2. DOI: 10.1136/ard-2024-226437
[3] Li Y, Li S, Zhao X, Sheng J, Xue L, Schett G, Shi C, Hu B, Wang X, Chen Z. Fourth-generation chimeric antigen receptor T-cell therapy is tolerable and efficacious in treatment-resistant rheumatoid arthritis. Cell Res. 2025 Mar;35(3):220-3. DOI: 10.1038/s41422-024-01068-2




