Deutscher Rheumatologiekongress 2025
Deutscher Rheumatologiekongress 2025
Erreichen der Therapieziele der EULAR/PRES Empfehlungen zur systemischen juvenilen idiopathischen Arthritis in der klinischen Praxis
Text
Einleitung: Erstmalig wurden gemeinsame Empfehlungen zur Diagnostik und Therapie der systemischen juvenilen idiopathischen Arthritis und des adult-onset Still-Syndroms erstellt [1]. Diese beinhalten auch ein treat-to-target Konzept, das ein Erreichen einer inaktiven Erkrankung (inactive disease, ID) unter einer maximalen Prednisolonäquivalentdosis von 0,2 mg/kg zu Monat 3 und Erreichen einer inaktiven Erkrankung ohne Kortikosteroide zu Monat 6 beinhaltet.
Methoden: Das Biologika in der Kinderrheumatolologie-Register (BiKeR) dienst der Überwachung der Anwendung von Biologika (und JAK-Inhibitoren) in der Kinderrheumatologie [2]. Hierbei werrden Patienten prospektiv verfolgt, der Verlauf dokumentiert. Die BiKeR-Datenbank wurde genutzt um Patienten zu identifizieren, die eine Therapie mit den Biologika Anakinra, Canakinumab oder Tocilizumab erhielten. Das Erreichen einer inaktiven Erkrankung wurde nach den Kriterien für den sJASAS [3] definiert.
Ergebnisse: 36 Patienten erhielten Anakinra als ein erstes Biologikum, 42 Canakinumab und 78 Tocilizumab. Die Patientencharakteristika sind in Tabelle 1 [Tab. 1] detailliert dargestellt. Aufgrund des offenen Charakters einer Registerstudie ergeben sich Unterschiede: Während das Erkrankungsalter vergleichbar war, war die Erkrankungsdauer mit durchschnittlich 0,4 Jahren bei Patienten der Anakinra-Kohorte kürzer (einzig Anakinra ist zu Primärtherapie vor Kortikosteroiden zugelassen). In der Tocilizumabkohorte war der Anteil der Patienten mit aktiven Gelenken höher und ebenso die mittlere Anzahl aktiver Gelenke. Dagegen hatten weniger Patienten bei Therapiebeginn aktive systemische Krankheitsmanifestationen. Kortikosteroide wurden häufiger parallel zu Tocilizumab eingesetzt als zu Anakinra oder Canakinumab.
Tabelle 1: Patientencharakteristika bei Therapiestart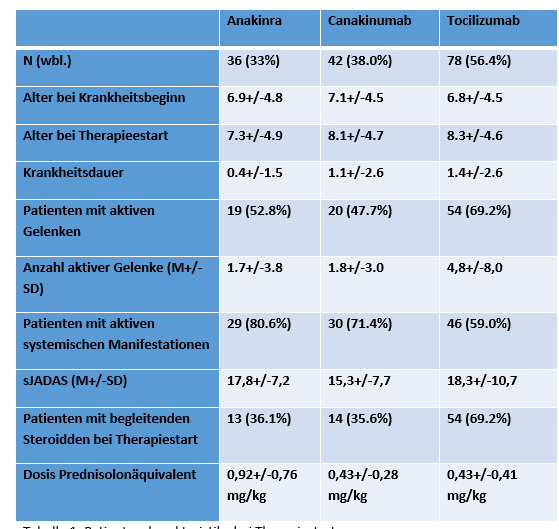
In der „as observed“ Analyse wurde das Therapieziel ID +/- niedrig dosierte Kortikosteroide zu Monat 3 bei 65,5%/81,8%/48,4% in der Anakinra-/Canakimumab-/Tocilizumabkohorte erreicht. Das Therapieziel der ID ohne Kortikosteroide zu Monat 6 wurde von 62,5%/83,3%/60,0% in der Anakinra-/Canakimumab-/Tocilizumabkohorte erreicht. In der Intention-To-Treat-Analyse erreichten in der Anakinra-/Canakimumab-/Tocilizumabkohorte 59,4%/77,0%/26,2% zu Monat 3 und 52,0%/79,5%/56,6% zu Monate 6 die EULAR/PRES Target. Die Therapie wurde bei 10 (28%) Patienten der Anakinrakohorte, bei 9 (21%) der Canakinumab- und 17 (22%) der Tocilizumabkohorte beendet. Häufigster Abbruchgrund in der Anakinrakohorte war Ineffektivität (5; 14%), in der Canakinumabkohorte Remission (4; 10%) und in der Tocilizumabkohorte gleich häufig Ineffektivität und Remission (je 6; 8%).
Schlussfolgerung: Registerdaten aus der klinischen Praxis zeigen häufiges Erreichen der von der EULAR/PRES empfohlen Targets bei der Behandlung der systemischen juvenilen idiopathischen Arthritis mit Il1 oder IL-6 Hemmern. Relative Unterschiede zwischen den Kohorten sind aufgrund des Designs der Registerstudie nur eingeschränkt bewertbar.
Abbildung 1 [Fig. 1]
Abbildung 1: Intention-To-Treat-Kohorte: Erreichen einer inaktiven Erkrankung unter Anakinra (ANA), Canakinumab (CAN) oder Tocilizumb (TOC) mit max. 0.2 mg/kg Prednisolonäquivalent zu Monat 3 bzw. 6 bzw. ohne Steroide.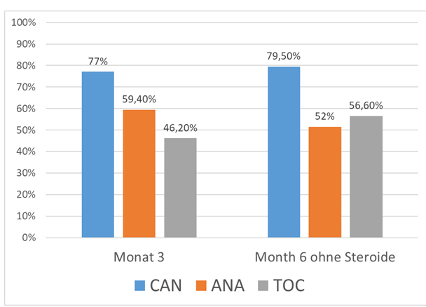
Literatur
[1] Fautrel B, Mitrovic S, De Matteis A, Bindoli S, Antón J, Belot A, Bracaglia C, Constantin T, Dagna L, Di Bartolo A, Feist E, Foell D, Gattorno M, Georgin-Lavialle S, Giacomelli R, Grom AA, Jamilloux Y, Laskari K, Lazar C, Minoia F, Nigrovic PA, Oliveira Ramos F, Ozen S, Quartier P, Ruscitti P, Sag E, Savic S, Truchetet ME, Vastert SJ, Wilhelmer TC, Wouters C, Carmona L, De Benedetti F. EULAR/PReS recommendations for the diagnosis and management of Still's disease, comprising systemic juvenile idiopathic arthritis and adult-onset Still's disease. Ann Rheum Dis. 2024 Nov 14;83(12):1614-27. DOI: 10.1136/ard-2024-225851[2] Horneff G, Schulz AC, Klotsche J, Hospach A, Minden K, Foeldvari I, Trauzeddel R, Ganser G, Weller-Heinemann F, Haas JP. Experience with etanercept, tocilizumab and interleukin-1 inhibitors in systemic onset juvenile idiopathic arthritis patients from the BIKER registry. Arthritis Res Ther. 2017 Nov 22;19(1):256. DOI: 10.1186/s13075-017-1462-2
[3] Rosina S, Rebollo-Giménez AI, Tarantola L, Pistorio A, Vyzhga Y, El Miedany Y, Lotfy HM, Abu-Shady H, Eissa M, Osman NS, Hassan W, Mahgoub MY, Fouad NA, Mosa DM, Adel Y, Mohamed SEM, Radwan AR, Abu-Zaid MH, Tabra SAA, Shalaby RH, Nasef SI, Khubchandani R, Khan A, Maldar NP, Ozen S, Bayindir Y, Alsuweiti M, Alzyoud R, Almaaitah H, Vilaiyuk S, Lerkvaleekul B, Alexeeva E, Dvoryakovskaya T, Kriulin I, Bracaglia C, Pardeo M, De Benedetti F, Licciardi F, Montin D, Robasto F, Minoia F, Filocamo G, Rossano M, Simonini G, Marrani E, Abu-Rumeileh S, Kostik MM, Belozerov KE, Pal P, Bathia JN, Katsicas MM, Villarreal G, Marino A, Costi S, Sztajnbok F, Silva RM, Maggio MC, El-Ghoneimy DH, El Owaidy R, Civino A, Diomeda F, Al-Mayouf SM, Al-Sofyani F, Dāvidsone Z, Patrone E, Saad-Magalhães C, Consolaro A, Ravelli A. Defining Criteria for Disease Activity States in Systemic Juvenile Idiopathic Arthritis Based on the Systemic Juvenile Arthritis Disease Activity Score. Arthritis Rheumatol. 2024 Sep;76(9):1446-54. DOI: 10.1002/art.42865




