Deutscher Rheumatologiekongress 2025
Deutscher Rheumatologiekongress 2025
Einfluss von Umweltbelastungen aus der Luft auf Häufigkeit und Krankheitsaktivität der rheumatoiden Arthritis in Deutschland – eine Querschnittsuntersuchung der NAKO Gesundheitsstudie
Text
Einleitung: Umwelteinflüsse wirken sich von der Empfängnis bis ins hohe Alter ein Leben lang auf den menschlichen Körper aus. Der Einfluss von Luftschadstoffbelastungen und Feinstäuben auf Systemerkrankungen, insbesondere die Rheumatoide Arthritis wurde für verschiedene deutsche Regionen untersucht, ist aber für Deutschland noch nicht flächendeckend erfasst. Ziel dieser Arbeit ist es daher, Zusammenhänge von Luftverschmutzung auf Häufigkeit und Krankheitsaktivität der Rheumatoiden Arthritis (RA) in Deutschland zu beschreiben.
Methoden: In der NAKO Gesundheitsstudie wurden Anamnese- und Untersuchungsbefunde von insgesamt 204.729 Personen einer Bevölkerungsstichprobe aus 18 Studienzentren im Zeitraum 03/2014–11/2019 erfasst. Bei 23.456 Personen erfolgte zusätzlich eine klinische Handuntersuchung von 20 Gelenken zu Schmerz und Schwellung durch trainierte Untersucher (Level3-Subkohorte) [1], welche die Berechnung des DAS28 als Maß für die rheumatische Krankheitsaktivität ermöglichte. Luftschadstoffbelastungen wurden kumulativ und tagesbezogen retrospektiv für die NAKO Untersuchungsregionen durch das Environmental Data Unit in München verfügbar gemacht (Luftschadstoffe (UBA: Feinstaub Partikelgröße (PM)2.5, PM10, Stickoxid (NO2) und Ozon (O3)) auf 1 km genau zum Wohnort auf Tagesbasis; Luftschadstoffe (ELAPSE: PM2.5, NO2, O3, Black Carbon (BC)) auf 100m genau für 2010 [2]. Die Analysen wurden adjustiert zu Alter, Geschlecht, Rauchstatus, BMI und Einkommen.
Ergebnisse: Bei 4.033 Personen der Gesamtkohorte (1.97%) und 426 Personen (1.82%) der Level3-Kohorte war eine RA bekannt (Minimum Zentrum: 1.35%; Maximum Zentrum: 3.4%). Die Krankheitsaktivität in der Kohorte war gering (Mittelwert DAS28 1.37, Standardabweichung 1.03). Das Auftreten einer RA war positiv assoziiert mit dem Alter (10 Jahres OR =1.65 [95%KI:1.59–1.71]) sowie weiblichem Geschlecht (OR=2.67 [2.46–2.90]). Personen mit RA waren im Durchschnitt 57 Jahre alt (vs. 50 Jahre ohne RA), 71% weiblich (50%). 39% (vs. 44%) gaben an nie, 36% (vs. 32%) früher geraucht zu haben und 18% (vs. 20%) sind aktuell rauchend.
Die historischen (ELAPSE) und tagesaktuellen (UBA) Umweltbelastungen des jeweiligen Wohnortes zeigten eine hohe Assoziation mit der Krankheitsaktivität. Regionen mit der höchsten Feinstaubbelastung im Jahresmittel (PM2,5 >18 µg/m³) waren Berlin, Essen und Düsseldorf, während Kiel und die Regionen in Mecklenburg-Vorpommern die niedrigste Belastung zeigten (PM2,5 <15 µg/m³). Freiburg zeigte die höchste (>55 µg/m³), Düsseldorf die niedrigste (<40 µg/m³) Ozonbelastung.
Es zeigte sich kein klinisch relevanter Effekt für Feinstaubbelastung auf die Häufigkeit der RA für PM2,5 und PM10, NO2 und BC sowohl für die aktuelle als die historische Messung, allerdings war die Häufigkeit bei höherer Ozonbelastung niedriger.
Die Feinstaubbelastung für PM2,5 und PM10, NO2 und BC war positiv assoziiert mit der Krankheitsaktivität der RA. Dagegen wies die Ozonbelastung eine negative Assoziation mit Krankheitsaktivtät auf.
Schlussfolgerung: Es konnte eine klinisch relevante Assoziation der Krankheitsaktivität mit allen Luftschadstoff-belastungen für die RA in der über 200.000 Personen umfassenden Bevölkerungsstichprobe aufgezeigt werden. Ein relevanter Zusammenhang von Luftschadstoffbelastungen des aktuellen Wohnortes mit dem Auftreten von RA konnte hingegen nicht gezeigt werden. Die hier im Querschnitt aufgezeigten Ergebnisse, werden auch prospektiv in der NAKO Kohorte untersucht, um stärkere Aussagen in Hinblick auf eine Kausalität machen zu können. Insbesondere im Hinblick auf die aufgetretenen unterschiedlichen Häufigkeiten in den Untersuchungszentren.
Tabelle 1 [Tab. 1]
Tabelle 1: Effektstärken der Umwelteinflüsse auf die Häufigkeit der RA ausgewertet in der Level 1 Kohorte (n=204.729) und den DAS28 ausgewertet in der Level 3 RA Kohorte (n = 426). Alle Effektstärken beziehen sich auf skalierte Variablen (Mittelwert 0, Varianz 1).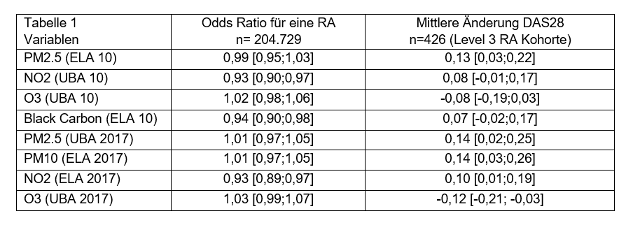
References
[1] Peters A; German National Cohort (NAKO) Consortium; Peters A, Greiser KH, Göttlicher S, Ahrens W, Albrecht M, Bamberg F, Bärnighausen T, Becher H, Berger K, Beule A, Boeing H, Bohn B, Bohnert K, Braun B, Brenner H, Bülow R, Castell S, Damms-Machado A, Dörr M, Ebert N, Ecker M, Emmel C, Fischer B, Franzke CW, Gastell S, Giani G, Günther M, Günther K, Günther KP, Haerting J, Haug U, Heid IM, Heier M, Heinemeyer D, Hendel T, Herbolsheimer F, Hirsch J, Hoffmann W, Holleczek B, Hölling H, Hörlein A, Jöckel KH, Kaaks R, Karch A, Karrasch S, Kartschmit N, Kauczor HU, Keil T, Kemmling Y, Klee B, Klüppelholz B, Kluttig A, Kofink L, Köttgen A, Kraft D, Krause G, Kretz L, Krist L, Kühnisch J, Kuß O, Legath N, Lehnich AT, Leitzmann M, Lieb W, Linseisen J, Loeffler M, Macdonald A, Maier-Hein KH, Mangold N, Meinke-Franze C, Meisinger C, Melzer J, Mergarten B, Michels KB, Mikolajczyk R, Moebus S, Mueller U, Nauck M, Niendorf T, Nikolaou K, Obi N, Ostrzinski S, Panreck L, Pigeot I, Pischon T, Pschibul-Thamm I, Rathmann W, Reineke A, Roloff S, Rujescu D, Rupf S, Sander O, Schikowski T, Schipf S, Schirmacher P, Schlett CL, Schmidt B, Schmidt G, Schmidt M, Schöne G, Schulz H, Schulze MB, Schweig A, Sedlmeier AM, Selder S, Six-Merker J, Sowade R, Stang A, Stegle O, Steindorf K, Stübs G, Swart E, Teismann H, Thiele I, Thierry S, Ueffing M, Völzke H, Waniek S, Weber A, Werner N, Wichmann HE, Willich SN, Wirkner K, Wolf K, Wolff R, Zeeb H, Zinkhan M, Zschocke J. Framework and baseline examination of the German National Cohort (NAKO). Eur J Epidemiol. 2022 Oct;37(10):1107-24. DOI: 10.1007/s10654-022-00890-5[2] Wolf K, Dallavalle M, Niedermayer F, Bolte G, Lakes T, Schikowski T, Greiser KH, Schwettmann L, Westerman R, Nikolaou N, Staab J, Wolff R, Stübs G, Rach S, Schneider A, Peters A, Hoffmann B. Environmental exposure assessment in the German National Cohort (NAKO). Environ Res. 2025 May 15;273:121259. DOI: 10.1016/j.envres.2025.121259




