German Congress of Orthopaedics and Traumatology (DKOU 2025)
Deutscher Kongress für Orthopädie und Unfallchirurgie 2025 (DKOU 2025)
In-vitro-Validierung eines optischen Detektionssystems für einen smarten Knie-Spacer zur quantitativen Infektionserkennung im zweizeitigen Prothesenwechsel
Text
Zielsetzung und Fragestellung: Periprothetische Gelenkinfektionen sind eine häufige Ursache für Revisionseingriffe nach Knieendoprothesen. Der zweizeitige Prothesenwechsel mit antibiotikahaltigen Spacern ist der Goldstandard. Diese Studie untersucht einen innovativen SmartSpacer mit optischen Sensoren zur Echtzeiterfassung des Infektionsstatus. Ziel ist es, den optimalen Zeitpunkt für die Reimplantation bei zweizeitiger Revision zu bestimmen, da bisher keine standardisierte Methode zur Bewertung der Infektionsfreiheit existiert.
Material und Methoden: Etablierung einer realitätsnahen in-vitro-Testumgebung eines infizierten Kniegelenks mit Synovialmembran in Modell-Flüssigkeit (Abbildung 1 [Abb. 1]). Dabei wurden Parameter wie Körpertemperatur, zeitabhängige Gentamicin-Konzentrationen, sowie verschiedene Erreger-Konzentrationen (S. epidermidis, ATCC® 25923TM) mit einbezogen, um sowohl high-grade als auch low-grade Infektionen zu simulieren.
Abbildung 1: In-vitro Testaufbau zur Evaluierung des SmartSpacers.
Ergebnisse: Das entwickelte In-vitro-Modell erwies sich als effektiv und zuverlässig. Die Synovialmembran mit anliegender Bindegewebsmatrix zeigte die erwartete Absorption des LED-Lichts und fungierte als selektive Barriere für die Bakteriensuspension. Ein besonderer Fokus lag auf der Verwendung verschiedener Membranproben, die sich in ihrer Oberflächenbeschaffenheit und Dicke unterschieden. Diese Variabilität führte zu unterschiedlichen Graden der Lichtabsorption und Abdunklung, was die Komplexität und Heterogenität realer Synovialmembranen widerspiegelt. Trotz dieser herausfordernden Bedingungen konnten die optischen Sensoren erfolgreich spektrale Fingerabdrücke für verschiedene Bakterienkonzentrationen (106, 104 und 102 KBE/ml) erfassen. Die Verwendung von PBS mit physiologischer Albuminkonzentration als Synovialflüssigkeits-Ersatz trug zur Verbesserung der Modellgenauigkeit bei.
Die präliminäre Datenanalyse, die sich auf den spektralen Bereich zwischen 510 nm und 610 nm konzentrierte, lieferte vielversprechende Ergebnisse. Die Charakterisierung der spektralen Fingerabdrücke hinsichtlich Amplitude, Standardabweichung und Fläche unter der Kurve (AUC) ermöglichte eine differenzierte Beurteilung der Bakterienkonzentrationen.
Diskussion und Schlussfolgerung: Diese ersten Ergebnisse unterstreichen die Validität und Flexibilität des In-vitro-Modells als Plattform für die weitere Erforschung der Bakteriendetektion in gelenkähnlichen Umgebungen. Die Fähigkeit des Systems, trotz variierender Membrancharakteristika zuverlässige Daten zu liefern, deutet auf ein hohes Potenzial zur Optimierung und klinischen Anwendung des SmartSpacer-Systems hin. Bei erfolgreicher Validierung folgt eine Tierstudie zur Bewertung von Leistungsfähigkeit und Sicherheit unter physiologischen Bedingungen.
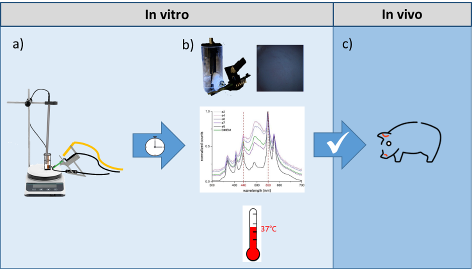
Abbildung 2 [Abb. 2]
Abbildung 2: Schematische Darstellung des In-vitro-Versuchsablaufs zur Evaluation des SmartSpacer-Systems. a) Herstellung des Synovialflüssigkeits-Analogons mit definierten Bakterienkonzentrationen (10²-106 KBE/ml). Fixierung der Synovialmembran vor der optischen Detektionseinheit. b) Datenanalyse mittels entwickeltem Algorithmus zur Auswertung der spektralen Fingerabdrücke. c) Nach Validierung der In-vitro-Ergebnisse: Übergang zu In-vivo-Studien.