German Congress of Orthopaedics and Traumatology (DKOU 2025)
Deutscher Kongress für Orthopädie und Unfallchirurgie 2025 (DKOU 2025)
Neue Methode zur Isolation humaner ostaler Makrophagen
Text
Zielsetzung und Fragestellung: Osteoporose ist die weltweit häufigste metabolische Knochenerkrankung und mit erheblicher Morbidität assoziiert. Seit der Einführung des Begriffs Osteoimmunologie im Jahr 2000 rückt die Interaktion zwischen Entzündungsprozessen und dem Knochenstoffwechsel zunehmend in den Fokus der Forschung. Makrophagen spielen dabei eine Schlüsselrolle. Eine spezifische, im Knochen ansässige Makrophagenpopulation, die sogenannten Osteomacs, wurde erstmals vor einigen Jahren beschrieben. Ihre Bedeutung für den Knochenstoffwechsel ist belegt, ihre Rolle in der Pathophysiologie der Osteoporose hingegen weitgehend ungeklärt. Während für murine Osteomacs bereits ein Isolationsprotokoll existiert, basierend auf dem Maus-spezifischen Makrophagen-Marker F4/80, fehlt bislang eine Methode zur Isolation humaner Osteomacs. Die hier gezeigte neue Isolationsmethode ist eine Erweiterung der Isolation primärer Osteoblasten, da in der Literatur gezeigt wurde, dass Osteomacs bei der Isolation von murinen Osteoblasten koisoliert werden und etwa 16% der Zellpopulation ausmachen. Eine zuverlässige Isolation dieser Zellen ist essenziell, um ihre Funktion bei der Osteoporose-Entstehung zu untersuchen.
Material und Methoden: Knochenproben wurden aus Hüftköpfen von Patienten mit Coxarthrose oder Schenkelhalsfraktur nach endoprothetischer Versorgung entnommen. Um eine Kontamination durch Knochenmark-Makrophagen (BMDMs) zu minimieren, wurde das Knochenmark durch wiederholtes Waschen mit Puffer entfernt. Anschließend erfolgte ein enzymatischer Verdau mit Kollagenase II und Dispase, wobei alle 15 Minuten die Zellen im Überstand durch Zentrifugation abgetrennt und die verbleibenden Knochenstücke mit frischer Kollagenase-Lösung erneut inkubiert wurden. Insgesamt wurden 5 Fraktionen gesammelt, wobei die erste verworfen wurde. Die Separation von Osteoblasten und Osteomacs erfolgte mittels magnetischer Zellseparation (MACS) unter Verwendung CD14-markierter Magnetbeads. Die resultierenden Zellfraktionen umfassten eine CD14-negative Population (Osteoblasten) und eine CD14-positive Population (Osteomacs). Nach einiger Zeit in Kultur wurden die Zellen gegen die Oberflächenmarker CD14, CD45, CD68, CD86, CD163, und CD209 mit Immunfluoreszenzfärbung angefärbt.
Ergebnisse: In der isolierten Zellfraktion konnte eine CD14+- und CD45+-positive Zellpopulation nachgewiesen werden, was auf Makrophagen und somit Osteomacs schließen lässt. Dabei konnte die interessante Beobachtung gemacht werden, dass diese sich häufig in langgestreckten, kettenartigen Strukturen mit anderen Osteomacs anordneten (Abbildung 1 [Abb. 1]). Des Weiteren waren diese Zellen auch positiv für die M1-Makrophagen-Marker CD68, CD86 und CD163. Teilweise konnten auch CD209-positive Zellen, ein Marker für M2-Polarisation von Makrophagen, in der Zellkultur beobachtet werden.
Abbildung 1: Immunfluoreszenzfärbung CD14+ Osteomacs 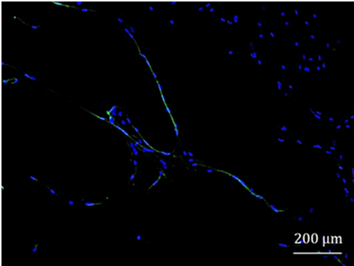
Diskussion und Schlussfolgerung: Wir beschreiben hier erstmals eine Methode zur Isolation humaner Osteomacs und zur Charakterisierung ihrer Polarisation. In Folgestudien soll die M1/M2-Polarisation mittels Durchflusszytometrie (FACS) bei gesunden Probanden und Osteoporose-Patienten quantifiziert werden. Die hier vorgestellte Methode ermöglicht weiterführende Untersuchungen zur Bedeutung von Osteomacs im Knochenstoffwechsel und liefert neue Einblicke in osteoimmunologische Mechanismen.




