Deutscher Rheumatologiekongress 2025
Deutscher Rheumatologiekongress 2025
Der Systemic Inflammatory Response Index (SIR) als Prognosefaktor der Rezidivgefahr bei Großgefäßvaskulitiden im den ersten zwei Jahren nach Diagnosestellung
Text
Einleitung: Großgefäßvaskulitiden (GGV) sind vaskuläre Entzündungen autoimmuner Genese der Aorta und ihrer Hauptabgänge. Laut Chapel Hill Consensus Confereance zählen die Riesenzellarteriitis (RZA) und die Takayasu-Arteriitis (TAK) zu den GGV [1]. Im weiteren Sinne können auch autoinflammatorische Aortitiden, zum Beispiel im Rahmen einer Retroperitonealen Fibrose (RF), dazu gezählt werden.
Rezidive sind bei GGV häufig: Raten von 30% und 80% bei RZA [2], [3] und von 50% bis 70% [4], [5], [6] bei TAK werden berichtet, mit dem höchsten Risiko in den beiden ersten Jahren nach Diagnoststellung [5], [7], [8]. Um den Verlauf einer GGV besser vorhersagen zu können, ist es von Interesse Prognosefaktoren für einen rezidivierenden Verlauf auszumachen.
Der Systemic Inflammatory Response Index (SIR) bewertet die Entzündungsaktivität mit jeweils einem Punkt für eine Körpertemperatur ≥38°C, Gewichtsverlust >4 kg, BSG ≥85 mm/h und Hämoglobin <11 g/d. Ein hoher SIR korreliert mit ischämischen Ereignissen [9], Glukokortikoidbedarf [10] und der Rezidivhäufigkeit [8]. Deshalb ist es Ziel dieser Arbeit zu ermitteln, ob der SIR ein geeigneter Prognosefaktor der Rezidivgefahr bei GGV in den ersten beiden Jahren nach Diagnosestellung ist.
Methoden: Die retrospektive Kohortenstudie basiert auf Daten des LVV-Registers Süd. Nach Ausschlüssen aufgrund unvollständiger SIR-Daten oder fehlender GGV-Diagnose standen 110 Patienten zur Auswertung zur Verfügung. Allerdings sind von 15 ihnen zu weniger als zwei Jahren und 10 zu weniger als einem Jahr zu Kontrolluntersuchungen erschienen. Bei allen wurde der SIR bei Erstdiagnose erhoben. Die statistische Analyse erfolgte mit SPSS.
Ergebnisse: Der initiale SIR war häufiger niedrig als hoch (siehe Abbildung 1 [Fig. 1]). Am häufigsten wurden keine Kriterien des Scores erfüllt; 5,5% der Stichprobe erfüllte alle vier Punkte.
Abbildung 1: SIR bei Erstdiagnose einer GGV (n = 110)
Von den Patienten, die mehr als ein Jahr lang nachbeobachtet wurden, rezidivierten 50,5% mindestens ein Mal. 23,8% erlitten zwei oder mehr Rezidive. Die Hälfte der Erstrezidive trat bereits innerhalb der ersten sechs Monate nach Diagnosestellung auf.
Um zu ermitteln, ob der initiale SIR mit dem Auftreten von Rezidiven in den ersten zwei Jahren nach Diagnosestellung korreliert, wurde ein Log-Rank-Test durchgeführt. Dieser stellte den Zusammenhang zwischen Höhe des SIR und Rezidivauftreten als nicht signifikant heraus (p=0,011; Breslow-Test: p=0,031; Tarone-Ware-Test: p = 0,021)
Schlussfolgerung: Anhand dieser Stichprobe konnte kein Zusammenhang zwischen initial erhobenem SIR und dem Rezidivauftreten in den ersten beiden Jahren nach Krankheitsbeginn festgestellt werden. Diese Ergebnisse decken sich nicht mit den Befunden von Nesher [8], der einen Zusammenhang zwischen der initialen Entzündungsaktivität und der Rezidivgefahr nachgewiesen hat. Ein möglicher Erklärungsansatz liegt in leicht voneinander abweichenden Parametern zur Erfassung der Entzündungsaktivität. Dies wirft die Frage auf, ob ein adaptierter SIR, der beispielsweise das CRP einbezieht, die Entzündungssituation präziser wiedergibt und als prognostischer Marker geeigneter wäre. Außerdem betrachtet Nesher nur RZA-Patienten. Ein Betrachten der Daten aufgeschlüsselt nach GGV-Entität wird in weiteren Analysen erfolgen.
Zudem könnte die routinemäßige Erhebung des SIR in unserem Zentrum seit 2020 Therapieentscheidungen zugunsten einer intensiveren Therapie beeinflusst haben, was potenziell das Rezidivrisiko gesenkt hat. Zur Klärung dieser Hypothese sind weitere Untersuchungen der Daten notwendig.
Abbildung 2 [Fig. 2]
Abbildung 2: Rezidivauftreten bei Patienten mit mindestens einem Jahr Ollow-Up (n=101)
Abbildung 3 [Fig. 3]
Abbildung 3: Kaplan-Meier-Kurve mit Rezidivgeschehen von Patienten mit mindestens einem Jahr Follow-Up; gruppiert nach SIR-Score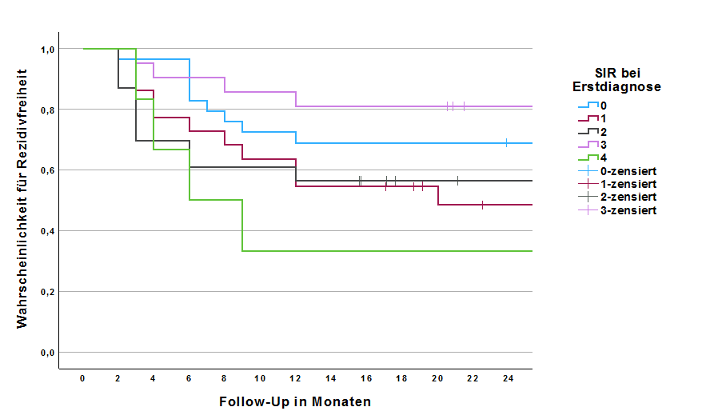
Literatur
[1] Jennette JC, Falk RJ, Bacon PA, Basu N, Cid MC, Ferrario F, Flores-Suarez LF, Gross WL, Guillevin L, Hagen EC, Hoffman GS, Jayne DR, Kallenberg CG, Lamprecht P, Langford CA, Luqmani RA, Mahr AD, Matteson EL, Merkel PA, Ozen S, Pusey CD, Rasmussen N, Rees AJ, Scott DG, Specks U, Stone JH, Takahashi K, Watts RA. 2012 revised International Chapel Hill Consensus Conference Nomenclature of Vasculitides. Arthritis Rheum. 2013 Jan;65(1):1-11. DOI: 10.1002/art.37715[2] Kermani TA, Warrington KJ, Cuthbertson D, Carette S, Hoffman GS, Khalidi NA, Koening CL, Langford CA, Maksimowicz-McKinnon K, McAlear CA, Monach PA, Seo P, Merkel PA, Ytterberg SR; Vasculitis Clinical Research Consortium. Disease Relapses among Patients with Giant Cell Arteritis: A Prospective, Longitudinal Cohort Study. J Rheumatol. 2015 Jul;42(7):1213-7. DOI: 10.3899/jrheum.141347
[3] Labarca C, Koster MJ, Crowson CS, Makol A, Ytterberg SR, Matteson EL, Warrington KJ. Predictors of relapse and treatment outcomes in biopsy-proven giant cell arteritis: a retrospective cohort study. Rheumatology (Oxford). 2016 Feb;55(2):347-56. DOI: 10.1093/rheumatology/kev348
[4] Ohigashi H, Haraguchi G, Konishi M, Tezuka D, Kamiishi T, Ishihara T, Isobe M. Improved prognosis of Takayasu arteritis over the past decade--comprehensive analysis of 106 patients. Circ J. 2012;76(4):1004-11. DOI: 10.1253/circj.cj-11-1108
[5] He S, Li R, Jin S, Wang Y, Li H, Duan X, Pan L, Wu L, Wang Y, Zhang Y, Wu Z, Li J, Yang Y, Tian X, Zeng X. Predictors of relapse in Takayasu arteritis. Eur J Intern Med. 2023 May;111:105-12. DOI: 10.1016/j.ejim.2023.02.027
[6] Comarmond C, Biard L, Lambert M, Mekinian A, Ferfar Y, Kahn JE, Benhamou Y, Chiche L, Koskas F, Cluzel P, Hachulla E, Messas E, Resche-Rigon M, Cacoub P, Mirault T, Saadoun D; French Takayasu Network. Long-Term Outcomes and Prognostic Factors of Complications in Takayasu Arteritis: A Multicenter Study of 318 Patients. Circulation. 2017 Sep 19;136(12):1114-22. DOI: 10.1161/CIRCULATIONAHA.116.027094
[7] Restuccia G, Boiardi L, Cavazza A, Catanoso M, Macchioni P, Muratore F, Cimino L, Aldigeri R, Crescentini F, Pipitone N, Salvarani C. Flares in Biopsy-Proven Giant Cell Arteritis in Northern Italy: Characteristics and Predictors in a Long-Term Follow-Up Study. Medicine (Baltimore). 2016 May;95(19):e3524. DOI: 10.1097/MD.0000000000003524
[8] Nesher G, Nesher R, Mates M, Sonnenblick M, Breuer GS. Giant cell arteritis: intensity of the initial systemic inflammatory response and the course of the disease. Clin Exp Rheumatol. 2008 May-Jun;26(3 Suppl 49):S30-4.
[9] Cid MC, Font C, Oristrell J, de la Sierra A, Coll-Vinent B, López-Soto A, Vilaseca J, Urbano-Márquez A, Grau JM. Association between strong inflammatory response and low risk of developing visual loss and other cranial ischemic complications in giant cell (temporal) arteritis. Arthritis Rheum. 1998 Jan;41(1):26-32. DOI: 10.1002/1529-0131(199801)41:1<26::AID-ART4>3.0.CO;2-0
[10] Hernández-Rodríguez J, García-Martínez A, Casademont J, Filella X, Esteban MJ, López-Soto A, Fernández-Solà J, Urbano-Márquez A, Grau JM, Cid MC. A strong initial systemic inflammatory response is associated with higher corticosteroid requirements and longer duration of therapy in patients with giant-cell arteritis. Arthritis Rheum. 2002 Feb;47(1):29-35. DOI: 10.1002/art1.10161




