German Congress of Orthopaedics and Traumatology (DKOU 2025)
Deutscher Kongress für Orthopädie und Unfallchirurgie 2025 (DKOU 2025)
MicroRNA miR-16-5p wird in der Frakturheilung lokal exprimiert, systemisch sezerniert und ist ein mutmaßlicher Regulator der MAPK und PI3K-AKT Signalwege
Text
Zielsetzung und Fragestellung: MicroRNA 16-5p (miR-16-5p) wird in der Literatur sowohl als pro-osteogen zum Beispiel durch Axin2-Inhibition, sowie als anti-osteogen beschrieben (beschleunigte Frakturheilung korrelierte mit reduzierter Plasma miR-16-5p). Unklar bleibt der für die Frakturheilung relevante Syntheseort von miR-16-5p. Ziel dieser Untersuchung war somit die korrelative Analyse der lokalen und systemischen Expression von miR-16-5p während der Frakturheilung in Maus und Mensch sowie die bioinformatische Prädiktion möglicher Zielsignalwege.
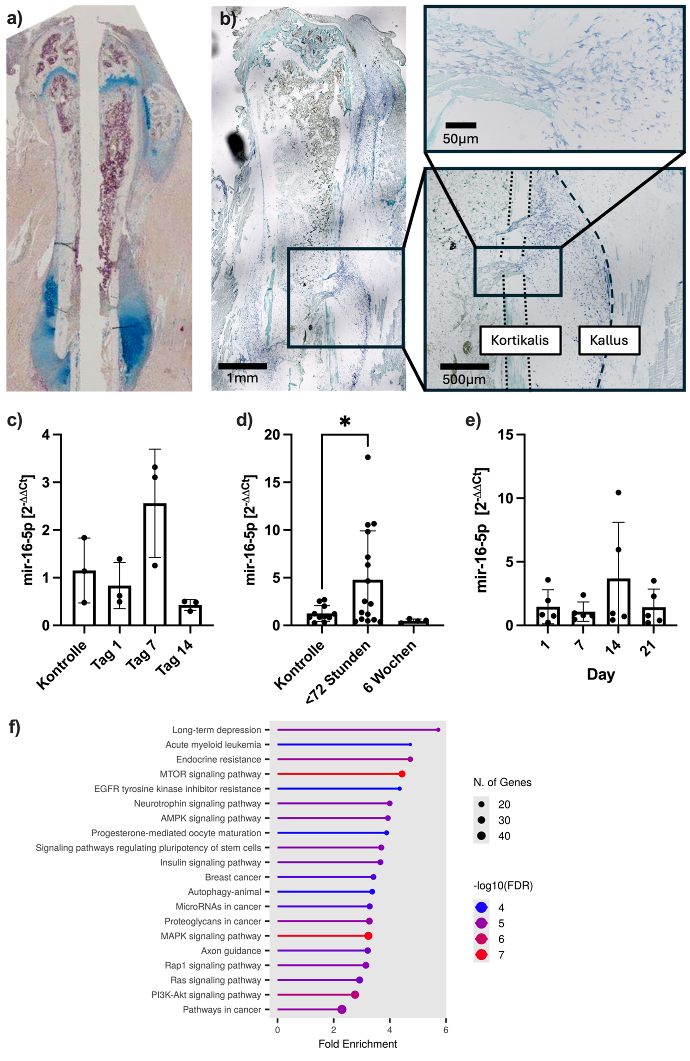
Material und Methoden: Eine geschlossene Femurschaftfraktur wurde in 12 Wochen alten C57Bl/6J Mäusen erzeugt und mittels retrograder Schraubenosteosynthese stabilisiert. Serum (Tag1, 7, 14) sowie Gewebeschnitte (Tag 7) des Knochens wurde asserviert (Tierversuchsantrag 84–02.04.2012.A016 und 81–02.04.2019.A164). Frakturschnitte wurden mit Alcian Blau gefärbt. RNA wurde mit in-situ Hybridisierung (ISH) mit dem miRCURY LNA miRNA ISH Kit (QIAGEN) detektiert.
Humane Serumproben während der Frakturheilung (< 72 Stunden n=15; 6 Wochen n=4) und von gesunden Kontrollen (n=11) wurden asserviert (Ethikvotum 2022-321-f-S). Primäre humane mesenchymale Stammzellen (hMSC) wurden isoliert (Ethikvotums 2021-625-f-S) und osteoblastär differenziert. EVs und RNA wurden mit folgenden Kits isoliert und mittels qPCR mit miCURY LNA SYBR Green PCR Assays analysiert (alles QIAGEN):
EVs aus humanem Blut: miCURY Exosome Serum/Plasma
RNA aus murinen Serum und humanen EVs: miRNeasy Serum/Plasma Advanced
RNA aus Zellen: miRNeasy Tissue/Cell Advanced
MicroRNA-Zielgene, die von vier der fünf Tools (miRmap, MiRWalk, miRDB, RNA22 und TargetScan8.0) prädiktiert wurden, wurden mittels ShinyGO 8.2 KEGG-Enrichment analysiert. Statistische Auswertung erfolgte mittels ANOVA in GraphPad Prism (Version 10.4.1). FDR bzw. p≤0,05 wurde als signifikant betrachtet.
Ergebnisse: Die Alcian Blau Übersichtsfärbung zeigt eindeutig den kartilaginären Kallus 7 Tage postoeprativ (Abbildung 1 a [Fig. 1]). Die ISH zeigt ein deutliches Signal im Kallusareal für miR-16-5p (mesenchymal-fibroblastäre Morphologie). Die qPCR zeigte eine gesteigerte Detektion von miR-16-5p während der Frakturheilung an Tag 7 im murinen Blut (Abbildung 1 c [Fig. 1]) und nach 72 Stunden in EVs im humanen Blut, welche sich nach 6 Wochen normalisierte (Abbildung 1 d [Fig. 1]). Während der osteoblastären Differenzierung von hMSCs zeigt sich eine gesteigerte Expression nach 14 Tagen (Abbildung 1 e [Fig. 1]). Die bioinformatische Auswertung zeigte unter anderem eine signifikante Enrichment der MAPK und PI3K-AKT Signalwege (Abbildung 1 f [Fig. 1]).
Diskussion und Schlussfolgerung: Die Daten zeigen, dass miR-16-5p lokal im Frakturkallus exprimiert wird und korrelierend im Serum nachweisbar ist. Die Expression von mir-16-5p durch hMSCs deutet darauf hin, dass diese eine Quelle der miR-16-5p Expression sein könnten. Das signifikante Enrichment der miR-16-5p Zielgenen in den für die osteoblastäre Differenzierung und Frakturheilung relevanten MAPK und PI3-AKT Signalwege deutet darauf hin, dass miR-16-5p über diese ein lokaler Regulator der Frakturheilung sein könnte.