German Congress of Orthopaedics and Traumatology (DKOU 2025)
Deutscher Kongress für Orthopädie und Unfallchirurgie 2025 (DKOU 2025)
Hierarchisch strukturiertes Biomaterial zur Induktion endogener Knochenregeneration ohne Verwendung von Knochentransplantat oder Wachstumsfaktoren
Text
Zielsetzung und Fragestellung: Bis heute ist in der Klinik kein Biomaterial verfügbar welches durch intrinsische Bioaktivität die Regeneration von Knochen aktiv unterstützen kann, obwohl dies eine wichtige Erweiterung der Behandlungsoptionen darstellen würde. Wir konnten zeigen, dass ein weiches, kollagenbasiertes Biomaterial mit gerichteten Poren in der Lage ist, einen endochondralen Ossifikationsprozess (EO) in Knochendefekten kritischer Größe zu induzieren, der der Knochenbildung in der Wachstumsfuge ähnelt (Petersen et al., Nat Commun. 2018).
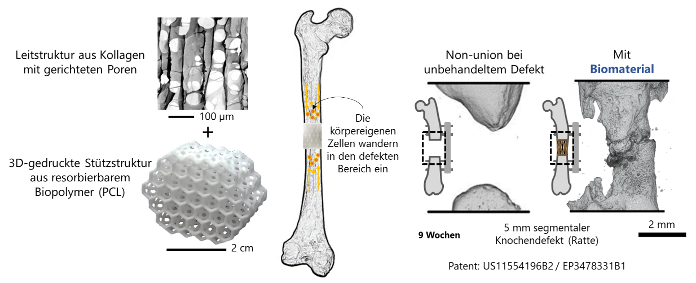
Können die mechanischen Eigenschaften dieses strukturierten, kollagenbasierten Biomaterials durch die Integration einer 3D-gedruckten Stützstruktur so verbessert werden, dass ein Einsatz in großen Defekten, perspektivisch im Menschen, möglich ist, ohne die bioaktiven Eigenschaften zu verlieren?
Material und Methoden: Stützstrukturen wurden aus Polycaprolacton (PCL) mittels selektivem Lasersintern hergestellt und mit der kollagenbasierten Leitstruktur kombiniert. Hierdurch entsteht ein hierarchisch-strukturiertes Biomaterial mit optimierten mechanischen und strukturellen Eigenschaften. Die mechanische Dauerfestigkeit unter zyklischer Belastung und der Einfluss auf die Zellrekrutierung wurden in vitro im Bioreaktor charakterisiert. Anschließend wurde die Knochendefektheilung in vivo im Klein- (5mm segm. Femurdefekt Ratte) und Großtiermodell (3cm segm. Tibiadefekt Schaf) evaluiert. Die Analyse der Knochenheilung erfolgte mittels Röntgenaufnahmen sowie Mikro-Computertomographie (µ-CT) und (Immun-)Histologie.
Ergebnisse: Das Zellrekrutierungspotenzial der kollagenbasierten Leitstruktur im Biomaterial wurde nicht beeinträchtigt, während die mechanische Steifigkeit durch die Stützstruktur um etwa drei Größenordnungen erhöht wurde. Im Rattenfemur induzierte das Biomaterial in allen Tieren die erwartete EO. Im Vergleich zur reinen Kollagen-Leitstruktur war die Ausrichtung der gebildeten Matrixfasern erhöht, was den endochondralen Heilungsprozess stabilisierte. Nach neun Wochen zeigte sich eine beginnende Defektüberbrückung. Die Implantation in den Schaf-Tibiadefekt war aufgrund der stabilisierenden Wirkung der Stützstruktur problemlos möglich. Im Heilungsverlauf bildeten sich auch hier hochausgerichtete Kollagenfasern welche den nachfolgenden Mineralisierungsprozess gezielt leiteten.
Diskussion und Schlussfolgerung: Durch die Integration einer PCL-Stützstruktur in eine Kollagen-Leitstruktur konnten die Eigenschaften des Biomaterials im Hinblick auf eine Anwendung in großen Knochendefekten deutlich verbessert werden. Aufgrund der aktivierten Rekrutierung von Zellen in das Biomaterial werden vergleichbare Heilungsergebnisse erreicht, wie sie bei bestehenden Biomaterialansätzen nur in Kombination mit autologem Knochen bekannt sind. Im Klein- und Großtiermodell führt die Ausrichtung der extrazellulären Matrixstrukturen zu einem gerichteten Knochenheilungsprozess. Mit dem Ziel der Translation in die Klinik laufen derzeit präklinische Studien im Rahmen des Zulassungsprozesses.
Abbildung 1 [Fig. 1]
Abbildung 1: Überbrückung eines überkritischen Knochendefekts in der Ratte durch Induktion endogener Knochenheilungsprozesse nach Implantation des mechanisch und strukturell optimierten Biomaterials.